
题目列表(包括答案和解析)
2. 把SO2通入Fe(NO3)3溶液中,溶液由棕色变为浅绿色,但立即又变为棕黄色,这时若滴入BaCl2溶液,会产生白色沉淀。在上述一系列变化过程中,最终被还原的是
A.SO2 B.Cl -
C.Fe3+ D.NO3 –
1. 一种新型净水剂PAFC(聚合氯化铁铝,[AlFe(OH)nCl6-n]m,n 5,m
5,m 10),广泛用于生活用水的净化和废水的净化,有关PAFC的说法正确的是
10),广泛用于生活用水的净化和废水的净化,有关PAFC的说法正确的是
A.PAFC用于净化饮用水时,可以除去水中所有的有害物质
 B.PAFC中铁显+2
B.PAFC中铁显+2
C.PAFC可看作一定比例的氯化铝和氯化铁的水解产物
D.PAFC在强酸性或强碱性溶液中都能稳定存在
28.(10分)我国规定饮用水质量标准必须符合下列要求:
|
pH |
6.5-6.8 |
|
Ca2+、Mg2+总浓度 |
<0.0045mol/L |
|
细菌总数 |
<100个/L |
以下是源水处理成自来水的工艺流程示意图:

源水→曝气池 一级沉降池 二级沉降池 过滤池→自来水
(1)源水中含Ca2+ 、Mg2+、HCO3-、Cl-等,加入石灰后生成Ca(OH)2 ,进而发生若干复分解反应,写出其中一个离子方程式 。
(2)凝聚剂除去悬浮固体颗粒的过程 (填写编号,多选倒扣分),
①只是物理过程 ②只是化学过程 ③是物理和化学过程
FeSO4.7H2O是常用的凝聚剂,它在水中最终生成 沉淀。
(3)通入二氧化碳的目的是 和 。
27.(12分)在两份体积相同的NaOH溶液A、B中,分别通入CO2气体,充分反应后,在所得溶液中分别加入1mol/L的盐酸,所加盐酸体积(mL)与产生CO2气体的体积(L)的关系如图所示,
V(CO2)/L

 A
A







 4.48
B
4.48
B

0 200 600 800 V(盐酸)/mL
 试填写下列空白:
试填写下列空白:
(1)两份NaOH溶液A和B的物质的量浓度之比 ,通入CO2气体的体积之比是(相同条件) 。
(2)与盐酸反应前,A溶液中的溶质是 ,其物质的量之比是 。
(3)与盐酸反应前,B溶液中的溶质是 ,其物质的量之比是 。
26.(10分)图中C至L分别表示反应中的一种常见物质,E、F、I在通常情况下是气体单质,其中E有刺激性气味,X、Y是常见的金属单质。W是由甲、乙元素按1∶1的比例组成的,其中甲元素的原子的M层电子数是K层的一半,乙元素的原子最外层电子数是次外层电子数的3倍。(参加反应的水和生成的水已从图中略去)
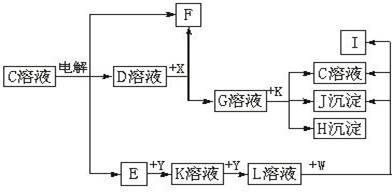
填写空白:
(1)E是___________(化学式),Y元素在周期表中的位置是______________________。
(2)写出K+G H+J+C的离子方程式________________________________。
H+J+C的离子方程式________________________________。
(3)写出W+L J+C+I的化学方程式_________________________________。
J+C+I的化学方程式_________________________________。
(4)设计实验分离H和J(写出所用试剂和操作方法):_____________________。
25.(12分)X、Y、Z、W原子序数依次增大的4种短周期元素,已知:
①X与Z、Y与W分别同族;
②X、Z、W分别与Y都可组成两种中学常见的化合物;
③Y的阴离子与Z的阳离子的核外电子排布相同;
④这4种元素的单质中有一种易溶于CS2溶剂。
(1)写出由Y与Z两元素形成化合物Z2Y2的电子式 。其化学键类型
有__________ 。
(2)写出2种均由这4种元素所组成的化合物在水溶液中发生反应的化学方程式______________。
 (3)用X、Y两元素的单质可制成已在阿波罗飞船中使用的新型电源,其结构如下图所示。两个电极均由多孔性碳构成,通入的两种单质由孔隙逸出在电极表面放电。
(3)用X、Y两元素的单质可制成已在阿波罗飞船中使用的新型电源,其结构如下图所示。两个电极均由多孔性碳构成,通入的两种单质由孔隙逸出在电极表面放电。
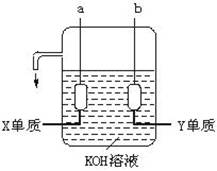

①a是电源的_____________极,电极反应式是______________________________;
②b电极上的电极反应式是___________________________。
24.(6分)汽车给人类生活带来极大便利,但随着车辆的增多,交通事故也相应增加。重视交通安全问题,关系到千百万人的生命安全与家庭幸福。为了尽可能地减轻由碰撞引起的伤害,汽车还装备了完全气囊系统,这个系统包括传感器、充气器、折叠气囊、点火器、固体颗粒等。其中固体颗粒的核心成分是NaN3、NaNO3、Fe2O3、SiO2等的混合物。当汽车前方受到高速碰撞时,装在车前端的 将碰撞信号传给 ,从而引发NaN3分解生成Na,并释放出大量的单质气体,使折叠气囊迅速膨胀,起到了阻止人体前冲的作用。该反应的化学方程式是: 。
23.(6分)礼花弹的药筒内装有火药、铝镁粉末和金属盐类等。礼花弹点燃后迅速升上高空,所需的动力是由其中的 燃烧产生的。礼花弹中的 在高温下产生绚丽多彩的火焰,在化学实验中称为 反应。
22.(12分)已知某纯碱试样中含有NaCl杂质,为测定试样中纯碱的质量分数,可用下图中的装置进行实验。
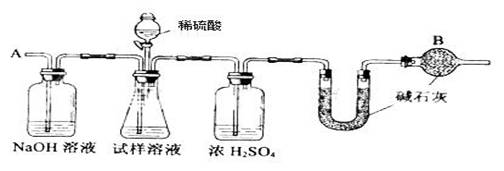
主要实验步骤如下:
①按图组装仪器,并检查装置的气密性
②将a g试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液
③称量盛有碱石灰的U型管的质量,得到b g
④从分液漏斗滴入6mol·L-1的硫酸,直到不再产生气体时为止
⑤从导管A处缓缓鼓入一定量的空气
⑥再次称量盛有碱石灰的U型管的质量,得到c g
⑦重复步骤⑤和⑥的操作,直到U型管的质量基本不变,为d g
请填空和回答问题:
 (1)在用托盘天平称量样品时,如果天平的指针向左偏转,说明 ;
(1)在用托盘天平称量样品时,如果天平的指针向左偏转,说明 ;
(2)装置中干燥管B的作用是 ;
 (3)如果将分液漏斗中的硫酸换成浓度相同的盐酸,测试的结果
(填偏高、偏低或不变);
(3)如果将分液漏斗中的硫酸换成浓度相同的盐酸,测试的结果
(填偏高、偏低或不变);
(4)步骤⑤的目的是 ;
(5)步骤⑦的目的是 ;
(6)该试样中纯碱的质量分数计算式为 。
21.(12分)下图(左)是还原铁粉与水蒸气反应的实验装置,实验时,B中灰色
的铁粉变为黑色,且生成的黑色固体物质是一种可溶于稀盐酸的较复杂化合物。请
回答下列问题:


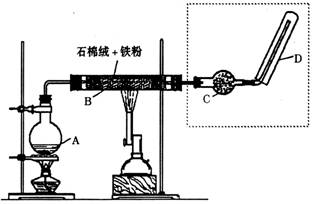
(1)B中发生反应的化学方程式为 。
(2)反应前A中投放碎瓷片的目的是 。
(3)某次实验后,取B中的固体物质少量,溶于足量稀盐酸,再滴加KSCN溶液。
溶液颜色无明显变化,试解释原因 。
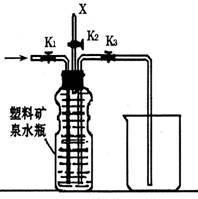
(4)上图(左)中虚线部分,可以用右图所示装置代替,在X口点燃收集到的气
体即可检验H2的存在。实验开始时,打开K1、K2,关闭K3,使反应先进行一段时间
之后,必须进行 操作,方可关闭K2、打开K3,再收集气体。当收集到半
瓶气体时,停止加热,关闭K1,若要使H2顺利逸出而进行点燃实验,操作的方法
是 。
(5)替代装置未像原装置那样使用干燥管,同样顺利完成了实验,原因是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com