
题目列表(包括答案和解析)
8.将NH4HCO3固体在试管中加热,使放出的气体依次通过足量的过氧化钠.盐酸溶液.浓H2SO4后,最后得到的气体是( )
A. NH3 B. CO2 C. H2O(气) D. O2
7.向含0.14mol Na2CO3的溶液中逐滴加入含一定量HCl的稀盐酸,经充分反应后,溶液中各溶质的物质的量判断可能正确的是( )
A. 得0.20mol NaCl和0.08mol NaHCO3
B. 剩0.04mol Na2CO3,得0.20mol NaCl
C. 剩0.06mol HCl,得0.14mol NaCl和0.14mol NaHCO3
D. 得0.06mol NaCl和0.08mol NaHCO3
6.向含有0.14mol Na2CO3的溶液中逐滴加入含有HCl 0.2mol的稀盐酸,经充分反应后,溶液中各物质的物质的量(mol)正确的是( )
|
|
Na2CO3 |
HCl |
NaCl |
NaHCO3 |
|
A |
0 |
0 |
0.20 |
0.08 |
|
B |
0.40 |
0 |
0.20 |
0 |
|
C |
0 |
0.06 |
0.14 |
0.14 |
|
D |
0 |
0 |
0.06 |
0.08 |
5.20℃时向50mL 1mol/L的碳酸钠溶液中滴加1mol/L的盐酸75mL,在液面上收集所产生的气体,这些气体经干燥后换算成标准状况下的体积为( )
A. 840mL B. 560mL
C. 小于840mL,大于560mL D. 略小560mL
4.体积同为aL的盐酸和K2CO3溶液,将K2CO3溶液逐滴加入盐酸中与盐酸逐滴加入K2CO3溶液中产生的气体体积比为x︰y(同温同压,且x≠y)。则原K2CO3溶液和盐酸溶液中溶质的物质的量浓度之比为( )
A. x︰y B. (x-2y)︰x C. 2x︰(2x-y) D. (2x-y)︰2x
3.将Na2O2和NaHCO3的均匀混和物粉未,等质量分成两份,其中一份中加入足量的稀盐酸,放出气体2.24L,将该气体通入另一份混和物中充分反应后,气体体积变为2.016L(气体体积均已折算到标准状况),则原混和物中Na2O2与NaHCO3的物质的量之比为( )
A. 3︰2 B. 2︰1 C. 8︰1 D. 2︰9
2.有一金属钠和过氧化钠的混和物,与过量水充分反应后,产生2.24L气体(STP),用电火花点燃后,恢复到标准状态,体积减少了1.12L,则原混和物中钠与过氧化钠的物质的量之比为( )
A. 1︰3 B. 5︰1 C. 1︰1 D. 1︰2
1.向300mL KOH溶液中缓慢通入2.24L(标准状况下)CO2气体,充分反应后,在减压低温下蒸发溶液,得到11.9g白色固体。则下列说法中正确的是( )
A. 此白色固体为KOH和K2CO3的混合物 B. 此白色固体中含有K2CO3 6.9g
C. 原KOH溶液的物质的量浓度是0.5mol/L D. 此白色固体为KHCO3
(二)乙组:

实验装置:

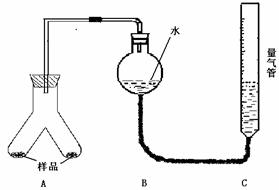
实验步骤:
①图连接好装置
 ②称取两份质量均为0.3g
的镁铝合金样品粉末,分别放入A装置左右两个管中,向B装置中加入一定量的水,把装置A、B的胶塞塞好,然后调节C的高度使B和C中的液面相平,记录下此时的体积为112 mL
②称取两份质量均为0.3g
的镁铝合金样品粉末,分别放入A装置左右两个管中,向B装置中加入一定量的水,把装置A、B的胶塞塞好,然后调节C的高度使B和C中的液面相平,记录下此时的体积为112 mL
③通过注射器的针头向装置A左侧管中注入足量的稀盐酸,等不再有气泡产生时,调节装置C的高度,使B和C中的液面相平时记录下此时的体积为448mL
④通过另一针头向装置A右侧管中加入足量的稀NaOH溶液,等不再有气泡产生时,调节装置C的高度,使B和C中的液面相平时记录下此时的体积为672mL。
问题和讨论:
(1)上述实验步骤①和②之间必须加一步 的操作,具体方法为 。
(2)为使气体体积测定结果不至于引起很大偏差,除了应注意使B和C中的液面相平外,在反应完全后至读数之前,还需要注意的关键问题是(只需写出1点) 。
(3)计算合金中铝的质量分数时,是否需要将气体体积折算为标准状况的体积 。
17.(5分)某化工厂排放的污水中含有Mg2+、Fe3+、Cu2+、Hg2+四种离子。甲、乙、丙三位学生分别设计了从该污水中回收纯净的金属铜的方案(见下图)
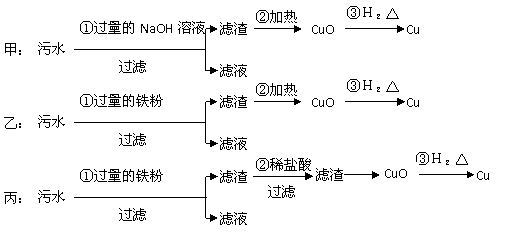


(1)甲、乙、丙提出的实验方案是否能得到纯净的金属铜?
甲 ,乙 ,丙 (填“能”或“不能”)。
(2)在能制得铜的方案中,哪一步操作会导致环境污染? 。应增加哪些措施防止污染? 。
18.(10分)A、B、C、D、E为易溶化合物,其离子组成为
|
阳离子 |
Fe3+、Ba2+、Al3+、Na+、Ag+ |
|
阴离子 |
NO3-、OH-、SO42-、Cl-、CO32- |
在各化合物中离子不重复,分别取其溶液进行实验,结果如下:
①在A溶液中逐滴加入氨水,有白色沉淀生成,继续加氨水至过量,沉淀消失;
②用pH试纸测得B和C溶液显碱性,0.1mol/L的C溶液pH小于13;
③在D溶液中加入铁粉,溶液质量增加;
④在E溶液中加入过量B,没有沉淀产生。
完成下列填空:
(1)A的化学式为 ;
(2)③反应的离子方程式为 ;
(3)检验D溶液中阴离子的的方法是 ;
 (4)E的的化学式为
,将E蒸干、灼热至质量不再改变,最后所得物质是(填化学式)
。
(4)E的的化学式为
,将E蒸干、灼热至质量不再改变,最后所得物质是(填化学式)
。
19. (10分)有一化合物X,其水溶液为浅绿色,可发生如下的转化关系(部分反应物、生成物从略)。其中B、D、E、F均为无色气体,W、K为常见的金属单质,C为难溶于水的红褐色固体。在混合液中加入BaCl2溶液可生成不溶于稀盐酸的白色沉淀,H和W反应可放出大量的热。
(10分)有一化合物X,其水溶液为浅绿色,可发生如下的转化关系(部分反应物、生成物从略)。其中B、D、E、F均为无色气体,W、K为常见的金属单质,C为难溶于水的红褐色固体。在混合液中加入BaCl2溶液可生成不溶于稀盐酸的白色沉淀,H和W反应可放出大量的热。
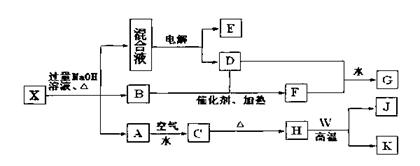
请回答下列问题:
(1) B气体的检验方法为 。
(2)按要求写出上述转化关系中有关反应的化学方程式:
①含有K元素的化合反应 。
②含有K元素的置换反应 。
(3) K与过量G的稀溶液反应的离子方程式为 。
(4) 物质X的化学式为 。
20.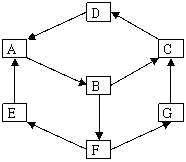 (10分)某兴趣活动小组利用物质间的互变,设计成一个平面魔方,如下图所示
(10分)某兴趣活动小组利用物质间的互变,设计成一个平面魔方,如下图所示
已知①A、B、C、D、G含有同种元素。
②
|
|
 纯A(单质) 纯A(单质) |
B溶液 |
D固体 |
G溶液 |
|
颜色 |
银白色 |
黄色 |
红棕色 |
浅绿色 |
③E是通常情况下密度最小的气体;B与硝酸银溶液反应生成不溶于稀硝酸的白色沉淀,也能将一种氧化物氧化为F,F是含有三种元素的化合物,与A反应生成E、G。
 依据以上信息填空:
依据以上信息填空:
(1)写出D的化学式 。
(2)G生成C的过程中所出现的现象为 。
(3)写出下列反应的化学方程式:
E→A ; A→B 。
(4)B→F的离子方程式为 。
21.(6分)现有一种碱金属的碳酸正盐和另一种碱金属的酸式碳酸盐组成的混合物试样0.506g,加热至质量不再变化为止,将生成的气体用足量的澄清石灰水吸收,得到白色沉淀0.200g。将加热后残留的固体与足量稀硫酸充分反应,生成的气体充分干燥后通过足量的过氧化钠粉末,过氧化钠粉末的质量增加0.084g。试回答:
(1)混合物中酸式碳酸盐物质的量为 mol。
(2)加热后残留固体中两碳酸盐物质的量之和为 mol。
(3)通过计算和推理确定混合物中两种盐的化学式分别为 。
(一)甲组:
实验方案:镁铝合金 测定剩余固体质量
测定剩余固体质量
实验步骤:
①称量 用托盘天平称量2.7g镁铝合金粉末
②溶解 把①中药品加入烧杯中,用规格为 mL的量筒量取一定体积1mol/L NaOH 溶液加入烧杯中,不断搅拌,充分反应
③过滤
④洗涤 若未对过滤所得固体进行洗涤,测得铝的质量分数将 (填“偏高”、“偏低”或“不变” ),证明固体已洗涤干净的方法为
⑤干燥、称量剩余固体
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com