
题目列表(包括答案和解析)
48. 取两种不同浓度的NaOH溶液各100mL,分别向两溶液中通入标准状况下的CO21.12L,完全反应后,将溶液低温蒸干得到不含结晶水的固体5g和6g。求两种溶液的物质的量浓度。
47. 将m mol Na2O2和n mol NaHCO3固体混合物在密闭容器中加热到250℃,让其充分反应后排出气体。
(1)分析m和n按不同比值进行反应时,容器内固体成分与排出气体成分的5种情况填写在下表中(设只有当CO2与Na2O2反应完后,H2O才与Na2O2反应)。
|
序号 |
m/n |
固体成分 |
排出气体物质成分 |
|
① |
<1/2 |
Na2CO3 |
|
|
② |
=1/2 |
Na2CO3 |
O2、H2O |
|
③ |
1/2<m/n<1 |
|
|
|
④ |
=1 |
|
|
|
⑤ |
>1 |
Na2CO3、NaOH、Na2O2 |
|
(2)当排出气体只含H2O(g)和O2两种成分且物质的量相等时,则原固体混合物中:
m︰n= 。
46.、现有NaOH和NaHCO3固体混和物0.2mol,在密闭容器中加热到250℃,让其充分反应,排出气体冷却,称得残留固体质量为Ag。
(1)写出可能发生的化学反应方程式:
(2)设混和物中NaOH为x mol(0<x<0.2=,问x为何值时残留固体为何种物质,并计算A的数值(可以用含x的式子表示),填表回答:
|
x值 |
残留固体(写分子式) |
A值 |
|
|
|
|
|
|
|
|
|
|
|
|
45. 质量为17.8g的KOH和KHCO3混合物,在250℃加热,冷却后发现混合物质量损失4.0g,求混合物中KOH、KHCO3质量分数各为多少?
44. 现有Na2O2和NaHCO3的混合物两等份,第一份混合物放入密闭容器中加热,使其充分反应;第二份混合物中加入足量的稀H2SO4。两种情况下得到同样的气体,但气体体积不同。前者产生气体的体积为a L,后者产生的气体体积为b L(气体体积都是在通常状况下测得,该条件下,气体的摩尔体积为VL/mol)。
现有Na2O2和NaHCO3的混合物两等份,第一份混合物放入密闭容器中加热,使其充分反应;第二份混合物中加入足量的稀H2SO4。两种情况下得到同样的气体,但气体体积不同。前者产生气体的体积为a L,后者产生的气体体积为b L(气体体积都是在通常状况下测得,该条件下,气体的摩尔体积为VL/mol)。
(1)第一份混合物加热充分反应后的固体残留物是 ,其物质的量为 。
(2)每份样品中Na2O2的物质的量为 ,NaHCO3的物质的量为 。
43. 已知25℃时,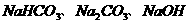 的溶解度分别为9g、33 g和110 g。现将NaOH溶于一定量水中,再向溶液中通入
的溶解度分别为9g、33 g和110 g。现将NaOH溶于一定量水中,再向溶液中通入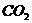 ,充分反应后,制得
,充分反应后,制得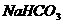 晶体。若制取33 g
晶体。若制取33 g 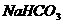 晶体,用水100 g,则需NaOH多少克?若用NaOH(固)17.86 g,则需用水多少克?
晶体,用水100 g,则需NaOH多少克?若用NaOH(固)17.86 g,则需用水多少克?
42. 过氧化钠是一种淡黄色固体,它能与二氧化碳反应生成氧气,在潜水艇中用作制氧剂,供人类呼吸之用.它与二氧化碳反应的化学方程式为: 2Na2O2 + 2CO2=2Na2CO3 + O2 。某学生为了验证这一实验,以足量的大理石、足量的盐酸和1.95克过氧化钠样品为原料,制取O2,设计出如下实验装置:
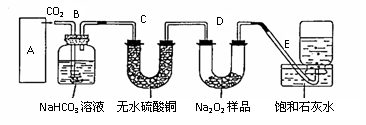

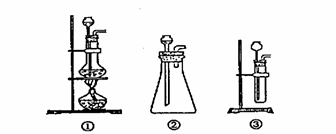 (1)A中制取CO2
的装置,应从下列图①、②、③中选哪个图:
(1)A中制取CO2
的装置,应从下列图①、②、③中选哪个图:
B装置的作用是吸收A装置中产生的盐酸酸雾,C装置内可能出现什么现象?
。为了检验E中收集到的气体,在取出集气瓶后,用 的木条伸入集气瓶内,木条会出现 。
(2)若E中石灰水出现轻微白色浑浊,请说明原因: 。
(3)当D中的1.95克过氧化钠样品接近反应完毕时,你预测E装置内有何现象?
。
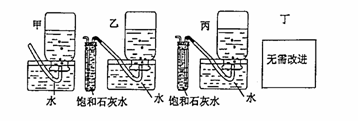
(4)反应完毕时,若测得E中的集气瓶收集到的气体为250毫升,又知氧气的密度为1.43克/升,当装置的气密性良好的情况下,实际收集到的氧气体积比理论计算值 (大或小),相差约 毫升(取整数值,所用数据均在标准状况下测定),这是由于 。 (5)你认为上述A---E的实验装置中,E部分是否安全、合理? ;E是否需要改进,若需要改进,应改为下图中的 。
41. 为了测定已部分变质的过氧化钠样品的纯度,设计右图所示的实验装置,图中Q为弹性良好的气球,称取一定量的样品放入其中,按图安装好仪器,打开了漏斗的活塞,将稀硫酸滴入气球中。请填空:
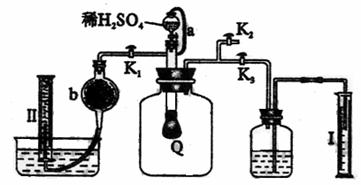
(1)Q内发生化学反应时,生成的气体是 。
(2)为了测定反应生成气体的总体积,滴加稀硫酸之前,K1、K2、K3中应当关闭的是 ,应当打开的是 。
(3)当上述反应停止,将K1、K2、K3均处于关闭状态,然后先打开K2,再缓缓打开
K1,这时可观察到的现象是 。
(4)b中装的固体试剂是 ,为什么要缓缓打开K1
。
 (5)实验结束时,量筒I中有x
mL水,量筒II中收集到y mL气体(已折算成标准状态),则过氧化钠的纯度的数学表达式是
(需化成最简表达式。
(5)实验结束时,量筒I中有x
mL水,量筒II中收集到y mL气体(已折算成标准状态),则过氧化钠的纯度的数学表达式是
(需化成最简表达式。
40. 高一新教材中有一演示实验,用脱脂棉包住约0.2g过氧化钠粉末,置于石棉网上,往脱脂棉上滴水,观察到脱脂棉剧烈燃烧起来。
(1)由上述实验现象所得出的有关过氧化钠跟水反应的结论是:
第一,有氧气生成,第二, 。Na2O2跟水反应的化学方程式是 ,
其中还原剂是 ,氧化剂是 。
(2)某研究性学习小组拟用A图所示装置(气密性良好)进行实验,以证明上述结论。用以验证第一条结论的实验方法是:
用以验证第二条结论的实验方法是:
(3)实验(2)往试管中加水至固体完全溶解且不再有气泡生成后,取出试管,往试管中滴入酚酞试液,发现溶液先变红后褪色。为探究其原因,该小组同学从查阅有关资料中得知:Na2O2与水反应可生成H2O2,H2O2具有强氧化性和漂白性。请设计一个简单的实验,验证Na2O2跟足量水充分反应后的溶液中有H2O2存在。(只要求写出实验所用的试剂及观察到的现象)
试剂: 。
现象: 。
 (4)该小组同学提出用定量的方法探究Na2O2跟水反应后的溶液中否含有H2O2,其实验方法为:称取2.6g Na2O2固体,使之与足量的水反应,测量产生O2的体积并与理论值比较,即可得出结论。
(4)该小组同学提出用定量的方法探究Na2O2跟水反应后的溶液中否含有H2O2,其实验方法为:称取2.6g Na2O2固体,使之与足量的水反应,测量产生O2的体积并与理论值比较,即可得出结论。
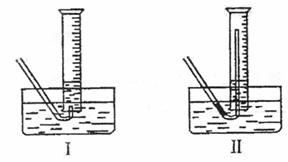

①测量气体体积时,必须待试管和量筒内的气体都冷却至室温时进行,应选用上图装置中的(忽略导管在量筒中所占的体积) (填序号),理由是
。
②若在标准状况下测量气体的体积,应选用的量筒的大小规格为
(选填“100mL”“200mL”“500mL”或“1000mL”)。
39. 现有一定量含有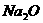 杂质的
杂质的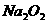 试样,请从下图中选用适当的实验装置,设计一个最简单的实验,测定
试样,请从下图中选用适当的实验装置,设计一个最简单的实验,测定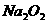 试样的纯度(可供选用的反应物只有
试样的纯度(可供选用的反应物只有 固体,20%盐酸和蒸馏水,并已知实验条件下
固体,20%盐酸和蒸馏水,并已知实验条件下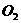 、
、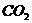 的密度)
的密度)
 请填写下列空白:(1)写出实验中
请填写下列空白:(1)写出实验中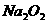 和
和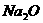 分别发生的反应的化学方程式_________________,_______________________________。
分别发生的反应的化学方程式_________________,_______________________________。
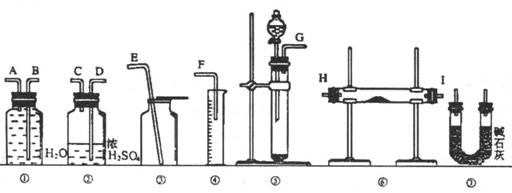
(2)应选用的装置是(只要求写出图中装置的标号)______________________________。
(3)所选用装置的连接顺序是(填各接口的字母;连接胶管省略)_______________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com