
题目列表(包括答案和解析)
2、稀硝酸与铜的反应的化学方程式 。
1、浓硝酸与铜的反应的化学方程式 。
3、浓硫酸的强氧化性
(1)浓硫酸与金属铜反应探究
[探讨 1]根据反应的现象,你能分步写出铜与浓硫酸反应的化学方程式吗?
[探讨2]上述反应中氧化剂、还原剂各是什么物质?被氧化与被还原的元素各是什么?还原剂与氧化剂物质的量之比是多少?浓硫酸的作用是什么?
[探讨3]考虑本实验的产物为有毒气体,请你想一想如何改进实验装置?若想同时证明SO2 溶液显酸性,如何改进实验装置?画出简图。
(2)浓硫酸与非金属(如C)的反应
[思考]根据氧化还原反应的规律,结合在蔗糖中加入浓硫酸的现象,写出浓硫酸与木炭反应的化学方程式吗?指出氧化剂、还原剂、氧化产物、还原产物吗?
(3)常温下,浓硫酸使铁、铝钝化
[浓硫酸、稀硫酸的组成及氧化性的比较]
 二、硝酸的氧化性
二、硝酸的氧化性
2、浓硫酸的脱水性:在蔗糖中加入浓硫酸现象①_____②_____③____。
蔗糖变黑的本质:
[思考]如果浓硫酸不慎沾到皮肤上,怎么办?
[比较]

1、浓硫酸的吸水性:在盛有少量硫酸铜晶体的试管里注入浓硫酸,现象___________ ,结论____________。
[思考]实验室为什么常用浓硫酸干燥气体?
14.(07年高考上海化学卷·26B)某课外研究小组,用含有较多杂质的铜粉,通过不同的化学反应制取胆矾。其设计的实验过程为:
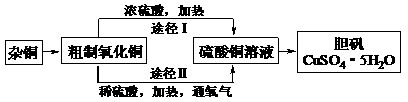
(1)杂铜中含有大量的有机物,可采用灼烧的方法除去有机物,灼烧时将瓷坩埚置于 上(用以下所给仪器的编号填入,下同),取用坩埚应使用 ,灼烧后的坩埚应放在 上,不能直接放在桌面上。
实验所用仪器:a.蒸发皿 b.石棉网 c.泥三角 d.表面皿 e.坩埚钳 f.试管夹
(2)杂铜经灼烧后得到的产物是氧化铜及少量铜的混合物,用以制取胆矾。灼烧后含有少量铜的可能原因是
a.灼烧过程中部分氧化铜被还原 b.灼烧不充分铜未被完全氧化
 c.氧化铜在加热过程中分解生成铜 d.该条件下铜无法被氧气氧化
c.氧化铜在加热过程中分解生成铜 d.该条件下铜无法被氧气氧化
(3)通过途径II实现用粗制氧化铜制取胆矾,必须进行的实验操作步骤:酸溶、加热通氧气、过滤、_____、冷却结晶、 、自然干燥。
(4)由粗制氧化铜通过两种途径制取胆矾,与途径I相比,途径II有明显的两个优点是:
、 。
(5)在测定所得胆矾(CuSO4·xH2O)中结晶水x值的实验过程中:称量操作至少进行 次。
(6)若测定结果x值偏高,可能的原因是
a.加热温度过高 b.胆矾晶体的颗粒较大
c.加热后放在空气中冷却 d.胆矾晶体部分风化
[答案](B)(1)c; e; b。 (2)a; b。 (3)蒸发; 过滤。
(4)产生等量胆矾途径II消耗硫酸少; 途径II不会产生污染大气的气体。 (5)4。 (6)a。
13.化学实验室制取氯化氢气体的方法之一是将浓硫酸滴入浓盐酸中。请从下图中挑选所需仪器,在方框内画出用该方法制备、收集干燥氯化氢气体的装置简图,并在图中标明所用试剂。(仪器可重复使用,固定装置不必画出)
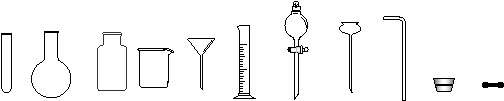

试管 圆底烧瓶 集气瓶 烧杯 普通漏斗 量筒 分液漏斗 长颈漏斗 导管 橡胶塞 橡皮管
Ⅱ.(11分)实验室制备少量硫酸亚铁晶体的实验步骤如下:取过量洁净的铁屑,加入20%-30%的稀硫酸溶液,在50℃-80℃水浴中加热至不再产生气泡。将溶液趁热过滤,滤液移至试管中,用橡胶塞塞紧试管口,静置、冷却一段时间后收集产品。
(1)写出该实验制备硫酸亚铁的化学方程式:____。
(2)硫酸溶液过稀会导致____。
(3)采用水浴加热的原因是____。
 (4)反应时铁屑过量的目的是(用离子方程式表示)____。
(4)反应时铁屑过量的目的是(用离子方程式表示)____。
(5)溶液趁热过滤的原因是___。塞紧试管口的目的是____。
(6)静置冷却一段时间后,在试管中观察到的现象是____。
[答案](19分)
Ⅰ.(8分)
Ⅱ.(11分)
(1)Fe+H2SO4(稀) FeSO4+H2↑
FeSO4+H2↑
(2)反应速率慢 不利于晶体析出
(3)(4)Fe3++2Fe=3Fe2+
(5)减少FeSO4的损失 防止空气进入试管将Fe2+氧化为Fe3+
(6)有浅绿色晶体析出
12.将4.2 g洗净的铁屑和25 mL 3 mol·L-1H2SO4充分反应,将反应液过滤,向滤液中加入用9.5 g硫酸铵晶体配成的饱和溶液,搅拌,加热,结晶出21.16 g晶体。求 (NH4)2SO4·FeSO4·6H2O的产率。
答案:75%
[拓展性练习]
12.用硫酸亚铁和硫酸铵制备硫酸亚铁铵,理论上硫酸亚铁和硫酸铵的物质的量之比应为 。实际上常使硫酸亚铁稍过量,其目的是防止
。
答案:1︰1 少量硫酸铵先于硫酸亚铁铵析出

11.制备硫酸亚铁铵的实验中,向新制的硫酸亚铁溶液中加入硫酸铵溶液时,常会出现 黄色。产生黄色的原因有两个:一是溶液的pH较 (填“高’’或“低,’);二是加入的硫酸铵溶液中含有 。可采取的相应措施:一是 ; 二是 。
答案:高 氧气 向硫酸亚铁溶液中加入适量的硫酸 将硫酸亚铁溶液煮沸除氧
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com