
题目列表(包括答案和解析)
1.(04上海)将表面已完全钝化的铝条,插入下列溶液中,不会发生反应的是
A.稀硝酸 B.稀盐酸 C.硝酸铜 D.氢氧化钠
3、酸式盐的热稳定性
(1)一般说来,正盐>酸式盐>相应的酸。如碳酸的水溶液稍受热就会分解,碳酸氢钠在270℃左右分解,而碳酸钠要在850℃以上的灼热条件下才会分解。
(2)一般说来,多元弱酸(如H2CO3 、H2SO3)易分解,其酸式盐受热也易分解,如2NaHSO3=Na2SO3+SO2↑+H2O,多元酸较稳定,其酸式盐也较稳定,如H2SO4较H2CO3稳定,则NaHSO4要较NaHCO3稳定。
典型例题剖析
[例1]对下列事实的解释错误的是
A.在蔗糖中加入浓硫酸后出现黑色物质,说明浓硫酸具有脱水性.
B.浓硝酸在光照下颜色变黄,说明浓硝酸不稳定.
C.常温下,浓硝酸可以用铝罐贮存,说明铝与浓硝酸不反应.
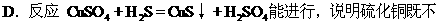 溶于水,也不溶于稀硫酸.
溶于水,也不溶于稀硫酸.
解析:A.解释正确.浓硫酸具有脱水性,可以把化合物中H和O以2∶1比例脱出,所以向蔗糖中加浓硫酸会发黑,此过程又叫蔗糖的碳化.
B.解释正确.浓硝酸在光照下颜色变黄,是因为硝酸见光分解,生成的NO2溶于硝酸溶液呈黄色。工业制浓盐酸发黄的原因,是因为其中含有Fe3+。
C.解释错误.正确解释为铝、铁与浓硝酸、浓硫酸常温下会发生钝化,在金属表面形成致密的氧化膜.
D.解释正确.既不能溶于稀硫酸,也不可溶于水的物质,中学阶段有CuS、PbS、Ag2S、HgS、BaSO4、AgCl等。
选C。
[例2]下列气体可用浓H2SO4干燥的是_________(填序号)。
①H2S ②SO2 ③H2 ④HCl ⑤Cl2 ⑥NH3 ⑦HBr ⑧HI ⑨PH3
解析:强还原性气体(H2S、PH3、HBr、HI等)和碱性气体(NH3、PH3等)不能用浓H2SO4干燥。答案:②③④⑤
[例3]同温同压下,两个等体积的干燥圆底烧瓶中分别充满①NH3②NO2,进行喷泉实验,如图所示,经充分反应后,瓶内溶液的物质的量浓度为
A.①>② B.①<② C.①=② D.不能确定
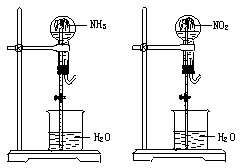
解析:设烧瓶的容积为V L,V L NH3全部溶于水,形成溶液的体积为V L,V L的NO2完全反应后,生成了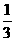 V L的NO气体,形成的溶液的体积为
V L的NO气体,形成的溶液的体积为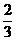 V L,从N原子守恒角度分析,
V L,从N原子守恒角度分析,
也有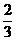 V L的NO2转化生成溶质HNO3.所以两溶液的物质的量浓度相等。答案:C。
V L的NO2转化生成溶质HNO3.所以两溶液的物质的量浓度相等。答案:C。
[例4]根据右图所示的A、B、C、D、E五种物质的相互转化关系,按如下要求填写相应的物质和有关反应的化学方程式。
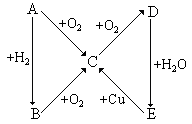
(1)当A是气体单质时,
A是 ,B是 ,C是 ,D是 ,E是 。
有关反应的化学方程式分别为: 。
(2)当A是固体单质时,A是 ,B是 ,C是 ,D是 ,E是 。有关反应的化学方程式分别为: 。
解析:根据一系列的转化关系,进行有关物质成分的推断,必须找到合适的突破点。
本题已知A是单质,A既能与O2反应,又能与H2反应,应是活泼性不很强的非金属单质。A经两步与O2的反应,产物D应为最高价氧化物。该氧化物对应的水化物E能与位于金属活动顺序表中H之后的金属Cu反应,E应是强氧化性酸,如浓H2SO4或HNO3。和HNO3对应的单质A是气体N2;和H2SO4对应的单质A是固体S。且N和S的氢化物都能跟O2反应,生成N和S的氧化物。知如上推断正确。
答案:(1)N2;NH3;NO;NO2;HNO3;
有关反应的化学方程式:
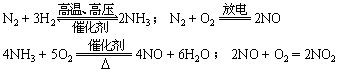
3NO2 + H2O == 2HNO3 + NO
3Cu + 8HNO3 == 2Cu(NO3)2 + 2NO + 4H2O
(2)S;H2S;SO2;SO3;H2SO4;
有关反应的化学方程式:
S + H2 H2S;S + O2
H2S;S + O2 SO2;2H2S + 3O2
SO2;2H2S + 3O2 2SO2 + 2H2O
2SO2 + 2H2O
2SO2 + O2 2SO3;SO3 + H2O == H2SO4
2SO3;SO3 + H2O == H2SO4
Cu + 2H2SO4(浓)  CuSO4 + SO2 + 2H2O
CuSO4 + SO2 + 2H2O
[例5]氨氧化制取硝酸时,如果由氨制成一氧化氮的产率是96%,由一氧化氮制成硝酸的产率是92%,试问10吨氨可以制得多少吨50%的硝酸?
解法:设制得50%的HNO3 x 吨
根据氨氧化法制硝酸的反应原理,得到
NH3 ------ HNO3
17g 63g
(10×96%×92%)吨 (x×50%)吨
得到:17∶8.832 = 63∶0.5x
解得:x = 65.46(吨)
答:制得50%的硝酸65.46吨。
知能训练
2、电离及溶液的酸碱性
(1)水溶液中:①NaHCO3=Na++ HCO3- HCO3-==H++CO32-②NaHSO4= Na++ H++ SO42-或NaHSO4= Na++ HSO4-
(2)熔化状态下:①2NaHCO3(熔)= Na2CO3+CO2↑+H2O,Na2CO3(熔)= 2Na++CO32-,(NaHCO3在熔化状态下不存在,要分解)。②NaHSO4= Na++ HSO4-
(3)水溶液的酸碱性
酸式盐溶于水后,溶液的酸碱性与酸式阴离子的电离和水解程度的大小有关,如果电离大于水解,则溶液显酸性;如果电离小于水解,则溶液显碱性。所以酸式盐溶液不一定显酸性,相反,绝大多数酸式盐水溶液显碱性,只有HSO4-、H2PO4-、HSO3-等盐的水溶液显酸性。
1、溶解性:绝大多数的酸式盐易溶于水,而且酸式盐的溶解度大于正盐。如Ca(HCO3)2>CaCO3,Mg(HCO3)2>MgCO3,但NaHCO3的溶解性小于Na2CO3
3、如果组成的铵盐的酸是具有强氧化性的酸,在较低的温度下慢慢分解可得到NH3和相应的酸。如NH4NO3:NH4NO3====HNO3+NH3↑。
由于硝酸具有氧化性,能将氨气氧化,从微热至不同的温度分别可得到N2O、NO2、N2O3、N2等。NH4NO3加热到190℃时分解生成一氧化二氮和水:NH4NO3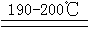 N2O↑+2H2O
N2O↑+2H2O
如果加热NH4NO3的温度达到480℃-500℃或NH4NO3受到撞击,分解生成氮气、氧气、水,发生爆炸。
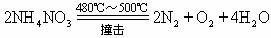
在特殊温度下才有可能放出氨气:NH4NO3 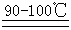 NH3↑+HNO3
NH3↑+HNO3
注意:NH4I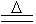 NH3↑+HI,
2HI
NH3↑+HI,
2HI H2+I2
H2+I2
2、如果组成的铵盐是难挥发性酸则固体铵盐受热分解时,只有氨呈气态逸出,而难挥发性的酸残留在加热的容器中。如(NH4)2SO4、(NH4)3PO4为此类铵盐。
(NH4)2SO4 2NH3↑+H2SO4 (NH4)3PO4
2NH3↑+H2SO4 (NH4)3PO4 3NH3↑+H3PO4
3NH3↑+H3PO4
1、如果组成铵盐的酸是挥发性的,则固体铵盐受热解时,氨气与酸一起挥发,冷却时又重新结合成铵盐。如NH4Cl为此类铵盐。
NH4Cl NH3+HCl
NH3+HCl
所谓氧化性酸是指酸根部分易于获得电子的酸,如浓H2SO4、HNO3等,由于其中S+6、N+5易获得电子,表现出很强的氧化性;而盐酸、氢硫酸、H2CO3、H3PO4等酸根部分不能或不易获得电子,所以它们是非氧化性酸。
在水溶液中任何酸都能不同程度地电离出H+,H+在一定条件下可获得电子形成H2,从这一点看,酸都具有氧化性,这是H+的氧化性,它和氧化性酸中中心元素处于高价态易获得电子具有的氧化性是不同的。
区别上述两个概念的关键在于:酸根部分易得电子→有氧化性→氧化性酸;酸电离出H+→有氧化性→酸的氧化性。
7、实验室制备氨气的其它方法(1)直接加热浓氨水(2)浓氨水与固体烧碱或生石灰混合
疑难点拨
6、实验室能不能用氢氧化钠与氯化铵反应制备氨气?为什么?______________________
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com