
题目列表(包括答案和解析)
22.(8分)在标准状况下,将质量为相同状况下同体积氢气质量16倍的CO2和CO的混合气体,充入盛有足量Na2O2且容积为2.24 L的密闭容器中(固体的体积忽略不计),用间断发生的电火花引发反应,使可能发生的反应充分进行。试计算:
(1)反应前充入容器中的CO2和CO的物质的量各是多少?
(2)最后容器中的生成物有哪些?其质量各是多少?
21.(8分)有机物X由C、H、O三种元素组成,X的沸点是198℃,已知:①在一定温度和压强下,在密闭容器中把4.2LX蒸气和16.0LO2混合点燃,当充分反应后,将温度和压强恢复到原来状况,得混合气体A为26.5L(已知在该实验状况下气体的摩尔体积为42.0L/mol);②当A处于标准状况下时,气体体积变为7.3L,此时测得气体对H2的相对密度为19.64。解答下列问题:
(1)推断气体A的组成(简述过程和结论)。
(2)计算A的各组分的物质的量。
(3)确定X的分子式和结构简式。
20. (10分)工业上制备氯化铜时,是将浓盐酸用水蒸汽加热至80℃左右,慢慢加入粗制氧化铜粉(含杂质氧化亚铁),充分搅拌,使之溶解,反应如下:
(10分)工业上制备氯化铜时,是将浓盐酸用水蒸汽加热至80℃左右,慢慢加入粗制氧化铜粉(含杂质氧化亚铁),充分搅拌,使之溶解,反应如下:
CuO + 2HCl = CuCl2 + H2O ,FeO + 2HCl = FeCl2 + H2O。
已知:pH≥9.6时,Fe2+以Fe(OH)2的形式完全沉淀;
pH≥4.4时,Cu2+以Cu(OH)2的形式开始沉淀; pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀;pH在3-4时,Fe3+以Fe(OH)3的形式完全沉淀。
⑴为除去溶液中Fe2+,可采用的方法是 。
⑵工业上为除去溶液中的Fe2+,常使用NaClO,当向溶液中加入NaClO后,可能发生反应的离子方程式为_____________________________________________________。溶液的pH变化是 。
⑶若此溶液只含Fe3+时,要调整pH在3-4之间,此时最好向溶液中加入 。
(4)已知溶液中c(Cu2+)与溶液pH的关系为lg c(Cu2+)=8.6-2pH,若溶液中c(Cu2+)为1 mol/L,要保证此溶液中Cu2+刚好不发生Cu(OH)2沉淀,则溶液pH应为___________,此时溶液中的铁离子能否沉淀完全_________(填“能”或“否”)。
19.(10分)已知水在25℃和95℃时,其电离平衡曲线如右图所示:
 (1)则25℃时水的电离平衡曲线应为 ,(填“A”或 “B”),请说明理由____________。
(1)则25℃时水的电离平衡曲线应为 ,(填“A”或 “B”),请说明理由____________。
(2)25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的 pH=7,则NaOH溶液与H2SO4溶液的体积比为____________。
(3)95℃时,若100体积pH1=a的某强酸溶液与1体积pH2 =b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH 1与强碱的pH 2之间应满足的关系是_____。
(4)曲线B对应温度下,pH=2的某HA溶液和pH=10的NaOH溶液等体积混合后,混合溶液的pH=5。请分析其原因:_____________________________________。
18.(8分)工业上生产盐酸,必须先合成氯化氢气体,生产中得到的氯化氢气体中或多或少都会含有生成氯化氢的一种反应物,将该混合物用蒸水吸收可得一定浓度的纯盐酸,此过程中逸出的气体可以循环利用。
(1)写出工业电解食盐水制取H2和Cl2的化学方程式:_________________________。
(2)工业上要得到纯盐酸并保障工人工作安全,如何合成氯化氢是关键的一步。则下列合成氯化氢气体的方法能达到生产目的的是________。
A.点燃H2和Cl2的混合物,二者体积(标准状况下测定)比为1∶1最合适
B.点燃H2和Cl2的混合物,二者体积(同温同压下测定)比不应为1∶1
C.纯净的H2在过量的Cl2中安静地燃烧
D.纯净的Cl2在过量的H2中安静地燃烧
(3)工业上电解质量分数为23.4%的精制食盐水a kg,电解后残液的密度为ρ kg/L。将产生的H2、Cl2在一定条件下反应制成质量分数为36.5%的盐酸b kg,已知H2、C12的利用率均为c%。
①残液中氯化钠的质量分数(用含a、b、c的代数式表示)为__________________。
②残液中NaOH的物质的量浓度(用含a、b、c、ρ的代数式表示)为___________。
17. (6分) (1)用惰性电极电解一定浓度的400mL硫酸铜溶液(不考虑电解过程中溶液体积的变化),通电一段时间后,向所得的溶液中加入0.1molCuO后,使溶液恰好恢复到电解前的浓度和pH,电解过程中转移的电子为________mol。
(2)如果向所得的溶液中加入0.1molCu(OH)2后,使溶液恰好恢复到电解前的浓度和pH,电解过程中转移的电子为________mol。
(3)如果向所得的溶液中加入0.1molCu2(OH)2CO3后,使溶液恰好恢复到电解前的浓度和pH(不考虑CO2的溶解),电解过程中转移的电子为________mol。
16.(6分)已知在一定温度下可发生反应: NO2+SO2==NO+SO3(g),且此反应为不可逆。现将一定温度下的NO和SO2混合气体100 mL通入容积固定的密闭容器中,试回答下列问题。(不考虑NO2转化为N2O4,气体体积均在相同条件下测定)。
(1)若向容器中通入40 mL O2后,容器中才开始出现不再褪去的红棕色,则原混合气体中的体积分数为 。
(2)若向容器中通入V mL O2后,容器中只有NO2和SO3两种气体,则V= mL。
 (3)若向容器中通入V
mL
O2时,要使容器内的压强保持不变,则V的取值范围是
。
(3)若向容器中通入V
mL
O2时,要使容器内的压强保持不变,则V的取值范围是
。
15.(6分)某斑铜矿(Cu5FeS4)和黄铜矿(CuFeS2)的混合物按下列流程联合生成铜和硫酸。假定富集后的矿物中只含Cu5FeS4和CuFeS2两种物质,试回答下列问题(假定各步反应均完全)。
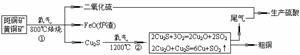
若混合物中含Fe1mol,实际生产中第①步消耗氧气_______mol;为使其中的铜全部转化为铜单质,依据配料第②步反应需再充入氧气的物质的量___________(填取值范围)。
14.将amL 0.1mol/L硫酸铝溶液与bmL 0.5mol/L氢氧化钠溶液混合,得到cmol氢氧化铝沉淀,若已知a、b、c中任意两个值,求另一个值,所求的值不止一个解的是(各选项中,单位均已略去)
A.a=100 b=90 c=?
B.a=100 c=0.015 b=?
C.b=90 c=0.015 a=?
D.a=75 c=0.015 b=?
第Ⅱ卷(非选择题,共72分)
13.许多小溪流经煤矿和金属矿,由于含硫矿床暴露在空气中或暴露到含氧的水中,使这些小溪中的水具有酸性,致使溪水中含有大量的硫酸亚铁,它们的浓度都很高。最常见的含硫矿是黄铁矿(FeS2),当富含铁的溪水和其他水混合时,溶于水的铁以针铁矿(FeO(OH))的形式沉淀出来,覆盖小溪的底部,而水仍保持酸性。如果黄铁矿全部转化成FeO(OH)和H+,那么要使1 L纯水的pH降到3.0,消耗FeS2的量为
A.2.5×10-4 mol B.1.25×10-4 mol
C.5×10-4 mol D.1×10-4 mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com