
题目列表(包括答案和解析)
10.有硫酸镁溶液500ml,它的密度是1.20g·cm-3,其中镁离子的质量分数是4.8%,则有关该溶液的说法不正确的是( )
A.溶质的质量分数是24.0% B.溶液的物质的量浓度是2.4 mol·L-1
C.溶质和溶剂的物质的量之比是1:40 D.硫酸根离子的质量分数是19.2%
9.VL浓度为0.5mol·L-1的盐酸,欲使其浓度增大1倍,采取的措施合理的是( )
A.通入标准状况下的HCl气体11.2VL
B.加入10mol·L-1的盐酸0.1 VL,再稀释至1.5 VL
C.将溶液加热浓缩到0.5 VL
D.加入VL1.5mol·L-1的盐酸混合均匀
8.事实上,很多非金属氧化物在一定条件下都能与Na2O2反应,且反应极有规律。如:Na2O2+SO2═Na2SO4,2Na2O2+2SO3═2Na2SO4+O2。据此,你认为下列反应方程式中正确的是( )
①2Na2O2+2Mn2O7═4NaMnO4+O2↑ ②Na2O2+2NO2═2NaNO2+O2
③2Na2O2+2N2O3═4NaNO2+O2 ④2Na2O2+2N2O4═4NaNO3
A. ①② B. ②③ C. ③④ D. ①④
7.物质氧化性、还原性的强弱,不仅与物质的结构有关,还与物质的浓度和反应温度有关。下列各组物质,由于酸(或盐)浓度的不同,而发生不同的氧化还原反应的是( )
①Fe与HNO3 ②Fe与FeCl3 ③Fe与H2SO4 ④Fe与HCl
A.只有① B.①③ C.只有③ D.②④
6. A、B两种物质的饱和溶液的质量分数随温度变化的曲线如下图。现分别在50gA和80gB中各加水150g加热溶解后并都蒸发掉水50g,冷却到t1℃,下列叙述正确的是( )
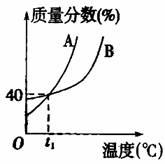 A. t1℃时溶液中A、B的质量分数相等
A. t1℃时溶液中A、B的质量分数相等
B.t1℃时溶液中A的物质的量浓度等于B的物质的量浓度
C. t1℃时析出固体B
D. t1℃时两者均无固体析出
5.铁屑溶于过量的稀硫酸,过滤后向滤液中加入适量硝酸,再加入过量的氨水,有红褐色沉淀生成。过滤、加热沉淀物至质量不再发生变化,得到红棕色的残查。上述沉淀和残查分别为( )
A.Fe(OH)3;Fe2O3 B.Fe(OH)2;FeO
C.Fe(OH)2、Fe(OH)3;Fe3O4 D.Fe2O3;Fe(OH)3
4.某含有Na+的澄清溶液中,可能还存在NH+4、Fe2+、I-、Br-、CO2-3、SO2-3六种离子中的几种。将该溶液进行如下实验:①滴加足量的新制氯水,有气泡生成,溶液变黄色;②向①中所得溶液中加入BaCl2溶液,无沉淀生成;③向①中所得溶液中加入淀粉溶液,不显蓝色。依据上述实验事实推断该溶液( )
A.一定存在Fe2+、Br-、CO2-3 B.一定是呈碱性
C.可能存在I-、SO2-3 D.可能存在NH+4
3.将SO2气体与足量Fe2(SO4)3溶液完全反应后,再加入K2Cr2O7溶液,发生如下两个化学反应:SO2+2Fe3++2H2O═SO2-4+2Fe2++4H+,Cr2O2-7+6Fe2++14H+=2Cr3++6Fe3++7H2O,有关说法正确的是( )
A.还原性Cr3+ >Fe2+>SO2 B.氧化性Cr2O2-7>SO2>Fe3+
C.两个反应中Fe2(SO4)3均作还原剂 D.Cr2O2-7能将Na2SO3氧化成Na2SO4
2.某溶液中含HCO-3、SO2-3、CO2-3、CH3COO-等四种阴离子,向其中加入足量的Na2O2
固体后,假设溶液体积无变化,溶液中离子浓度基本保持不变的是( )
A.CH3COO- B.HCO-3 C.CO32- D.SO42-
1.在下列溶液中,各组离子一定能够大量共存的是( )
A.使酚酞试液变红的溶液:Na+、Cl-、SO42-、Fe3+
B.使紫色石蕊试液变红的溶液:Na+、Fe2+、NO3-、Cl-
C.c(H+)=10-12mol·L-1的溶液:K+、Ba2+、Cl-、Br-
D.碳酸氢钠溶液:K+、SO2-4、Cl-、H+
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com