
题目列表(包括答案和解析)
2. 加成反应:有机物分子中不饱和的碳原子跟其他原子或原子团直接结合生成新物质的反应。(1)与氢气的加成反应(还原):在催化剂的作用下,含有不饱和碳原子的有机物跟氢气发生加成反应:a.烯、二烯、炔的催化加氢;b.苯、苯的同系物、苯乙烯催化加氢;c.醛、酮催化加氢;d.油脂的加氢硬化。(2)与卤素单质的加成反应:含有不饱和碳原子的有机物很容易跟卤素单质发生加成反应。(3)与卤化氢的加成反应:含有不饱和碳原子的有机物能跟卤化氢发生加成反应。例如:乙炔→氯乙烯。(4)与水的加成反应:含有不饱和碳原子的有机物在催化剂作用下,可以跟水发生加成反应。例如:烯烃水化生成醇。
加成反应:有机物分子中不饱和的碳原子跟其他原子或原子团直接结合生成新物质的反应。(1)与氢气的加成反应(还原):在催化剂的作用下,含有不饱和碳原子的有机物跟氢气发生加成反应:a.烯、二烯、炔的催化加氢;b.苯、苯的同系物、苯乙烯催化加氢;c.醛、酮催化加氢;d.油脂的加氢硬化。(2)与卤素单质的加成反应:含有不饱和碳原子的有机物很容易跟卤素单质发生加成反应。(3)与卤化氢的加成反应:含有不饱和碳原子的有机物能跟卤化氢发生加成反应。例如:乙炔→氯乙烯。(4)与水的加成反应:含有不饱和碳原子的有机物在催化剂作用下,可以跟水发生加成反应。例如:烯烃水化生成醇。
1.取代反应:有机物分子里的某些原子或原子团被其他原子或原子团所代替的反应。(1)卤代反应:有机物分子中的氢原子被卤原子取代的反应。(2)硝化反应:有机物分子中的氢原子被硝基取代的反应。(3)磺化反应:有机物分子中的氢原子被磺酸基取代的反应。(4)其他:卤代烃的水解、酯化反应、酯的水解、醇分子间脱水等也属于取代反应。
28.小苏打、达喜都是常用的中和胃酸的药物。
(1)小苏打片每片含0.42gNaHCO3,2片小苏打片和胃酸完全中和,被中和的H+是__ __mol。
(2)达喜的化学成分是铝和镁的碱式盐(含结晶水)。取该碱式盐3.01g,加入2.0mol·L-1盐酸使其溶解,加入盐酸至45.0mL时正好反应完全,并放出112mlCO2(已折算为标况下)。再在所得溶液中加入过量的氢氧化钠,过滤,沉淀物进行干燥后重1.74g。计算,该碱式盐样品中:氢氧根与碳酸根的物质的量之比 ;铝离子与镁离子的物质的量之比 ;若又知该碱式盐中氢元素的质量分数为0.040,推测该碱式盐的化学式为 。
27. (12分) 污水处理分析时,常用双硫腙(H2Dz,二元弱酸)把金属离子络合成电中性的物质,再用CCl4萃取络合物,从而把金属离子从水溶液中完全分离出来。如用双硫腙(H2Dz)-CCl4分离污水中的Cu2+时,先发生络合反应:Cu2++2 H2Dz Cu(HDz)2+2H+,再加入CCl4,Cu(HDz)2就很容易被萃取到CCl4中。
Cu(HDz)2+2H+,再加入CCl4,Cu(HDz)2就很容易被萃取到CCl4中。
(1)写出双硫腙和Fe3+络合的离子方程式: 。萃取过程中要控制适宜的酸度。如果溶液的pH过大,其后果是 。
下图是用双硫腙(H2Dz)-CCl4络合萃取某些金属离子的酸度曲线。它反映了萃取某些金属离子时适宜的pH范围。E%表示某种金属离子以络合物形式被萃取分离的百分率。
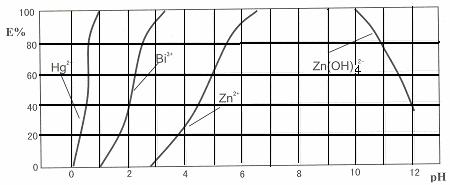
某工业废水中含有Hg2+、Bi3+、Zn2+,用双硫腙(H2Dz)-CCl4络合萃取法处理废水。请根据上图回答问题:
(2)欲完全将废水中的Hg2+分离出来,须控制溶液pH= 。
(3)当调节pH=2时,铋(Bi)的存在形式有: ,其物质的量之比为 。
(4)萃取到CCl4中的Zn(HDz)2分液后,加入足量的NaOH溶液,充分振荡后,锌又转到水溶液中。写出反应的离子方程式:
26.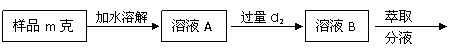 (12分)某食盐样品中混有NaBr杂质,为了测定该食盐样品的纯度,可设计实验过程如下:
(12分)某食盐样品中混有NaBr杂质,为了测定该食盐样品的纯度,可设计实验过程如下:

完成下列填空:
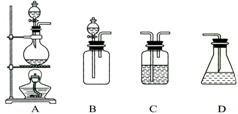 (1)请你从右图中选出用四个装置(可重复使用)来完成向溶液A中通入过量Cl2的实验,将所选出装置的选项字母填在横线上。括号中表示选出装置内所放的化学药品。
(1)请你从右图中选出用四个装置(可重复使用)来完成向溶液A中通入过量Cl2的实验,将所选出装置的选项字母填在横线上。括号中表示选出装置内所放的化学药品。
→ C → →
(饱和食盐水) (溶液A)
(2)根据实验过程所示,在萃取操作中应选用的有机溶剂为
A.四氯化碳 B.苯 C.乙醇 D.裂化汽油
(3)证明液体D中几乎不存在溴单质的实验操作是 。
(4)加热蒸发溶液D时,除需带有铁圈的铁架台、酒精灯、坩埚钳和火柴外,还必须用到的仪器有 。
(5)原食盐样品中NaCl的质量分数为 (用字母m、m1表示)
25.(16分)下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,回答下列问题:
|
族 周期 |
IA |
|
0 |
|||||
|
1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
|
2 |
|
|
|
② |
③ |
④ |
|
|
|
3 |
⑤ |
|
⑥ |
⑦ |
|
|
⑧ |
|
(1)④、⑤、⑥的原子半径由大到小的顺序为______________________(用元素符号表示)。
(2)①、②、④、⑤中的三种元素形成的某无机盐的用途是(举出一例即可) ;由这四种元素形成的某盐的式量为82,该盐的水溶液呈_______性,理由是(用离子方程式解释)______。
(3)由表中④、⑤两种元素的原子按1:1组成的化合物的电子式_________________。
由1mol该物质与2mol碳酸氢钠固体混合后,在密闭容器中加热充分反应,排出气体物质后冷却,残留的固体物质是 。
A.NaOH Na2CO3 B.Na2CO3 C.Na2O2 Na2CO3 D.Na2O2 NaOH Na2CO3
(4)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
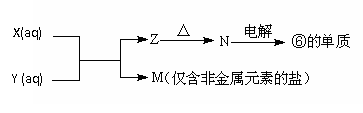
X溶液与Y溶液反应的离子方程式为_____________________,常温下,为使0.1 mol/L M 溶液中由M电离的阴、阳离子浓度相等,应向溶液中加入一定量的Y溶液至____________(填酸性、碱性或中性)。
24.在由Fe、FeO和Fe2O3组成的混合物中加入100mL 2mol/L的盐酸,恰好使混合物完全溶解,并放出448mL气体(S.P.T),此时溶液中无Fe3+。则下列判断正确的是
A.混合物中三种物质反应时消耗盐酸的物质的量之比为1:1:3
B.反应后所得溶液中的Fe2+和Cl–的物质的量之比为1:3
C.混合物中,FeO的物质的量无法确定,但Fe比Fe2O3的物质的量多
D.混合物中,Fe2O3的物质的量无法确定,但Fe比FeO的物质的量多
23、氯化铜(CuCl2·2H2O)中含FeCl2杂质。为制得纯净氯化铜晶体,首先将其制成水溶液,然后按下面所示操作步骤进行提纯:
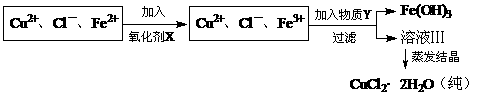
氧化剂X与物质Y的化学式分别是(已知完全转化成氢氧化物所需pH值:Fe3+为3.7,Cu2+为6.4,Fe2+为9.6。)
A.H2O2、CuO B.KMnO4、Na2O C.NaClO、Cu(OH)2 D.K2Cr2O7、NaOH
22.下列褪色过程不是因为氧化还原反应而褪色的是
A.SO2气体通入到溴水中使溴水褪色
B.氯水使滴有酚酞的NaOH溶液褪色,加入NaOH后不变红
C.碘水中加入甲苯使水层褪色
D.FeCl2溶液使紫色KMnO4溶液(酸性)褪去
21.在铁与铜的混和物中,加入一定量的稀硝酸,充分反应后
剩余金属m1g,再向其中加入一定量的稀硫酸,充分振荡后,
剩余金属m2g,m1与m2的关系是
A.m1一定大于m2 B.m1可能等于m2
C.m1一定等于m2 D.m1可能大于m2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com