
题目列表(包括答案和解析)
1. 设NA为阿伏加德罗常数,下列叙述中正确的是
A.1molCl2与足量铁反应转移的电子数是3NA
B.1mol氧单质含有的原子数是1mol氖气含有的原子数的两倍
C.标准状况下,11.2 LSO3中含有的S=O键的数目为1.5 NA
D.标准状况下,11.2L NO与11.2L O2混合后所含分子数小于NA
29.(16分)已知一个碳原子上连有两个羟基时,易脱水形成碳氧双键。请根据下图回答。
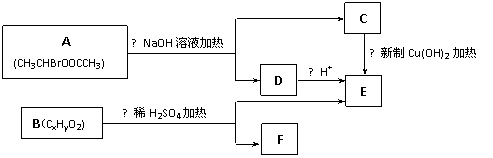
(1) E中含有的官能团的名称是_____________,反应②的反应类型是________________,
C跟新制的氢氧化铜反应的化学方程式为 。
(2) 已知B的相对分子质量为162,其燃烧产物中n(CO2)∶n(H2O)=2∶1。则B的分子式为______________,F的分子式为______________。
(3) 在电脑芯片生产领域,高分子光阻剂是光刻蚀0.11 μm线宽芯片的关键技术。F是这种高分子光阻剂生产中的主要原料。F具有如下特点:①能跟FeCl3溶液发生显色反应;②能发生加聚反应;③芳环上的一氯代物只有两种。F在一定条件下发生加聚反应的化学方程式为 。
(4)化合物G是F的同分异构体,它属于芳香族化合物,能发生银镜反应。G可能有________种结构,写出其中任一种同分异构体的结构简式________________。

27.(13分)
 t℃ 时,将2 mol SO2和1 mol O2通入体积为2 L的恒温恒容密闭容器中,发生如下反应:2SO2 ( g ) +O2
( g )
2 SO3 (g );ΔH = -196.6 kJ/mol。2min时化学反应达到平衡,此时测得反应物O2 还剩余0.8 mo1。请填写下列空白:
t℃ 时,将2 mol SO2和1 mol O2通入体积为2 L的恒温恒容密闭容器中,发生如下反应:2SO2 ( g ) +O2
( g )
2 SO3 (g );ΔH = -196.6 kJ/mol。2min时化学反应达到平衡,此时测得反应物O2 还剩余0.8 mo1。请填写下列空白:
(1)从反应开始至达到化学平衡,生成SO3的平均反应速率为_____________;平衡时SO2的转化率为__________________。
(2)下列叙述能证明该反应已经达到化学平衡状态的是(填标号,下同)__________
A.容器内压强不再发生变化
B.SO2的体积分数不再发生变化
C.容器内气体原子总数不再发生变化
D.相同时间内消耗2n mol SO2的同时消耗n mol O2
E.相同时间内消耗2n molSO2的同时生成n mol O2
(3)反应达到化学平衡后,以下操作将引起平衡向正反应方向移动并能提高SO2转化率的是_________________
A.向容器中通人少量O2 B.向容器中通入少量SO2
C.使用催化剂 D.降低温度
E.向容器中通入少量氦气(已知氦气和SO2、O2、SO3都不发生反应)
(4)t℃时,若将物质的量之比n(SO2):n(O2)= 1:1的混合气体通入一个恒温恒压的密闭容器中,反应达到化学平衡时,混合气体体积减少了20 %。SO2的转化率为________。
28(16分)
过氧化氢是重要的氧化剂、还原剂,它的水溶液又称为双氧水,常用作消毒、杀菌、漂白等。某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧化氢的含量,并探究了过氧化氢的性质。
Ⅰ.测定过氧化氢的含量
请填写下列空白:
(1) 移取10.00mL 密度为ρ g/mL的过氧化氢溶液至250mL ___________(填仪器名称)中,加水稀释至刻度,摇匀。移取稀释后的过氧化氢溶液25.00mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。
(2) 用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式如下,请将相关物质的化学计量数及化学式填写在方框里。
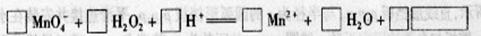
(3) 滴定时,将高锰酸钾标准溶液注入______________________(填“酸式”或“碱式”)滴定管中。滴定到达终点的现象是_________________________________________
(4) 复滴定三次,平均耗用c mol/L KMnO4标准溶液V mL,则原过氧化氢溶液中过氧化氢的质量分数为______________________________________。
(5) 若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果_________(填“偏高”或“偏低”或“不变”)。
Ⅱ.探究过氧化氢的性质
该化学兴趣小组根据所提供的实验条件设计了两个实验,分别证明了过氧化氢的氧化性和不稳定性。(实验条件:试剂只有过氧化氢溶液、氯水、碘化钾淀粉溶液、饱和硫化氢溶液,实验仪器及用品可自选。)
请将他们的实验方法和实验现象填入下表:
|
实 验 内 容 |
实 验 方 法 |
实 验 现 象 |
|
验证氧化性 |
|
|
|
验证不稳定性 |
|
|
26.(15分)用A+、B-、C2-、D、E、F、G和H分别表示含有18个电子的八种微粒(离子或分子),请回答:
(1)A元素是__________、B元素是__________、C元素是__________(用元素符号表示)。
(2)D是由两种元素组成的双原子分子,其分子式是__________。
(3)E是所有含18个电子的微粒中氧化能力最强的分子,其分子式是__________。
(4)F是由两种元素组成的三原子分子,其分子式是__________,电子式是__________。
(5)G分子中含有4个原子,其分子式是__________。
(6)H分子中含有8个原子,其分子式是__________。
13.X、Y为短周期元素,X位于IA族,X与Y可形成化合物X2Y,下列说法正确的是
A.X的原子半径一定大于Y的原子半径
B.X与Y的简单离子不可能具有相同的电子层结构
C.两元素形成的化合物中,原子个数比不可能为1:1
D.X2Y可能是离子化合物,也可能是共价化合物
11.下列各溶液中的离子组能大量共存的是 ( )
A.pH = 0的溶液中:K+、Fe2+ 、Cl-、NO3-
B.使蓝色石蕊试液变红的溶液中:Na+、K+、SO32-、HCO3-
C.c ( H+) = c (OH- )的溶液中:Na+、Ba2+、C1-、SO42-
D. 强碱性溶液中:Na+、K+、AlO2-、CO32-
12下列有关物质检验的实验结论正确的是
|
选项 |
实 验 操 作 及 现 象 |
实 验 结 论 |
|
A |
向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成 |
该溶液中一定含有SO2-4 |
|
B |
向某溶液中加入2滴KSCN溶液,溶液不显红色。再向溶液中加入几滴新制的氯水,溶液变为红色 |
该溶液中一定含有Fe2+ |
|
C |
将某气体通入品红溶液中,品红溶液褪色 |
该气体一定是SO2 |
|
D |
将少量某物质的溶液滴加到新制的银氨溶液中,水浴加热后有银镜生成 |
该物质一定属于醛类 |
10、据报道,科学家已成功合成了少量N4,有关N4的说法正确的是
A、N4是N2的同素异形体 B、N4是N2的同分异构体
C、相同质量的N4和N2所含原子个数比为1:2 D、N4的摩尔质量是56g
9.茉莉醛具有浓郁的茉莉花香,其结构简式如下所示:

关于茉莉醛的下列叙述错误的是
A.在加热和催化剂作用下,能被氢气还原 B.能被高锰酸钾酸性溶液氧化
C.在一定条件下能与溴发生取代反应 D.不能与氢溴酸发生加成反应
8.在盛有稀H2SO4的烧杯中放入用导线连接的锌片和铜片,下列叙述正确的是
A.正极附近的SO42-离子浓度逐渐增大B.电子通过导线由铜片流向锌片
C.正极有O2逸出 D.铜片上有H2逸出
7.已知:①1 mol H2分子中化学键断裂时需要吸收436kJ的能量
②1 mol Cl2分子中化学键断裂时需要吸收243kJ的能量
③由H原子和Cl原子形成1 mol HCl分子时释放431kJ的能量
下列叙述正确的是
A.氢气和氯气反应生成氯化氢气体的热化学方程式是H2(g)+Cl2(g)=2HCl(g)
B.氢气和氯气反应生成2 mol氯化氢气体,反应的△H=183kJ/mol
C.氢气和氯气反应生成2 mol氯化氢气体,反应的△H=-183kJ/mol
D.氢气和氯气反应生成1 mol氯化氢气体,反应的△H=-183kJ/mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com