
题目列表(包括答案和解析)
3、奥运向我们走来,“绿色奥运”的理念更加深入人心。对学习和掌握化学知识的人来说,“绿色化学”理念同样重要,你认为下列符合“绿色化学”理念,实现零排放的是( )
A、实验室制氧气 B、实验室制二氧化碳
C、用生石灰制熟石灰 D、实验室制氢气
2、用KMnO4、KClO3、H2O2三种物质都可制得氧气,说明这三种物质的组成中都含有( )
A、氧元素 B、氧化物 C、氧分子 D、氧原子
1、下面能量转化过程中,主要发生了化学变化的是( )
A、蜡烛照明 B、水力发电 C、太阳能供热 D、电热器取暖
25.(7分)NaOH潮解后极易与空气中的CO2反应生成Na2CO3而变质。为测定实验室一瓶放置已久的烧碱中NaOH含量,某同学取适量的烧碱样品,溶于一定量的水得到200g溶液;再加入200g稀硫酸(足量)充分搅拌到不再放出气泡为止,称量溶液为395.6g。
请计算:
(1)反应产生的CO2的质量为 g。
(2)若所取烧碱样品为50.0g,则样品中NaOH的质量分数是多少?
(3)用同浓度的硫酸,与一瓶未变质、部分变质、或全部变质(杂质都是Na2CO3)的烧碱样品反应,需要硫酸的质量都相等。其原因是:
(从钠元素质量守恒的角度解释)。
肇庆市2008年初中毕业生学业考试
24.(5分)为防止汶川地震灾区的病菌传播,防疫人员大量使用了“漂白粉”来杀菌消毒, “漂白粉”的有效成分为次氯酸钙[化学式为:Ca(ClO)2]。请回答:
(1)次氯酸钙中金属元素是 (写元素符号);钙、氯、氧三种元素的质量比为 。
(2)次氯酸钙中氯元素的质量分数是 (精确到0.1%)。
(3)若灾区饮用水每50kg至少需要漂白粉250g,则消毒一桶水(约20kg)至少须加漂白粉 g。
23.(9分)实验室常用的干燥剂“碱石灰”是CaO和固体NaOH的混合物,极易与空气中水蒸汽和CO2反应而变质。某同学对一瓶久置的“碱石灰”作了如下探究:
(1)[猜想]
猜想Ⅰ:没有变质,“碱石灰”只含有CaO、固体NaOH;
猜想Ⅱ:已完全变质,“碱石灰”全部变成了CaCO3和Na2CO3。
则CaO与水反应的反应方程式为 。
(2)[实验]如下图所示:
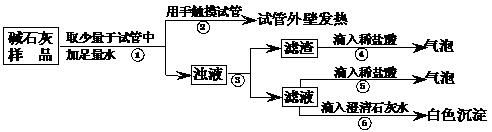
(3)[判断]
a.若Ca(OH)2、CaCO3和Na2CO3投入到水中不会放热,则由操作②现象判断:猜想Ⅱ (填:成立、不成立)
b.操作④发生化学反应的方程式为 ;由操作
⑤⑥的现象判断:滤液中含有 (写化学式);由此判断猜想Ⅰ (填:成立、不成立)。
c.综合a和b的结论,判断该样品变质情况为 。
(4)[拓展]由上述实验说明,实验室中“碱石灰”应 保存;操作③中玻棒的作用是 。
22.(13分)现有以下仪器,请回答下列问题:

(1)仪器⑤的名称是 ;取用粉末状固体必须用到的仪器是 (填序号)。
(2)如果用加热KMnO4的方法制取氧气,制气装置应选仪器 (填序号)。
(3)如果用H2O2分解来制取氧气,制气装置最好选用仪器 (填序号);其化学方程式为: ;这种装置还可以用来制CO2,其收集气体的方法为 法。
(4)比较(2)和(3)两种制取氧气的方法,最好选用方法(3)的原因是
。
(5)把上面分解KMnO4制取氧气的仪器装配好后,检验该装置气密性的操作方法为: 。
21.(8分)实验结束时,同学们将含有CuSO4、ZnSO4、FeSO4的废液倒在废液缸里,如果将废液直接排放就会造成水污染。于是几位同学利用课余处理废液,回收工业重要原料硫酸锌和有关金属。实验过程如下:
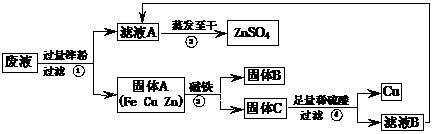
请回答:
(1)滤液A和滤液B含有相同的溶质,其名称是 ;固体B的化学式为 。
(2)写出步骤①其中一个反应的化学方程式 ;
步骤④发生反应的化学方程式为 。
(3)要检验步骤④中加入的稀硫酸是否足量的方法是
。
(4)若实验过程中的物质损失可以忽略,要计算该废液中硫酸锌的质量分数,必须称量:废液的质量和 。
20.(8分)依据所学化学知识回答:
(1)奥运火炬燃烧时主要是将化学能转变成热能和 能;火炬铝柄表面有一层致密的氧化铝保护膜,它是常温下铝与氧气反应生成的,该反应的化学方程式为: 。
(2)将“嫦娥一号” 送上太空的火箭推力巨大,因为它所使用的燃料是液氢、助燃剂是液氧,则液氢燃烧的化学方程式为 ;液氢作燃料除了单位质量燃烧的热能最大以外,还有一个与环保有关的优点是 。
(3)汶川地震灾后搭建的板房材料铝塑板,是在高压聚乙烯的基材中加入氢氧化铝等物质而制成,这种板材中的高分子化合物是 (写名称);震后救灾需要大量的消毒剂,我国研制出比漂白粉更高效的饮用水消毒剂“ClO2”,制取ClO2反应为:X+2NaClO2==2ClO2+2NaCl,则X的化学式为 。
19.(6分)某镇硫酸厂排出的尾气中含有SO2,废水中含有H2SO4 。请回答:
(1)该镇经常下酸雨,酸雨的pH 5.6(填:>、<、=);要粗略地测定酸雨pH,通常用精密 试纸。
(2)请举一例酸雨的危害: 。
(3)用熟石灰处理该厂废水的化学方程式为: 。
(4)该厂的下列整治措施不妥的是 (填序号):
A.废气循环利用 B.将废气点燃后排放
C.废水用碱中和后排放 D.改进工艺,减少废气废水的产生
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com