
题目列表(包括答案和解析)
7、用NA表示阿伏加德罗常数的值。下列叙述正确的是
A.常温下,2.24LN2和O2的混合气体所含原子数为0.2NA
B.常温下,0.01mol/L的醋酸溶液中所含有的H+数小于0.01NA
C.标准状况下,生成1mol氧化钠和1mol过氧化钠转移的电子数分别为2 NA和4 NA
D.标准状况下,6.72L CH4中所含的共用电子对数为1.2NA
6、将质量分数为a %的NaOH溶液蒸发掉mg水后,变成VmL 2a %的NaOH不饱和溶液,则蒸发后的溶液的物质的量浓度是
A. 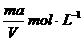 B.
B. 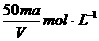
C. 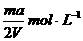 D.
D. 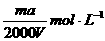
5、关于Na2CO3溶液和NaHCO3溶液,下列说法正确的是
A.用加热的方法区别两种溶液 B.用澄清的石灰水区别两种溶液
C.浓度相同时,Na2CO3溶液的pH大 D.浓度相同时,两溶液的pH相等
4、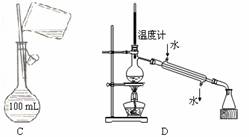 下列有关实验操作正确的是
下列有关实验操作正确的是
 A.称量氢氧化钠固体
B.检验铁粉与水蒸气反应产生的氢气
A.称量氢氧化钠固体
B.检验铁粉与水蒸气反应产生的氢气
C.配制150 mL 0.10 mol/L盐酸 D.分离两种互溶但沸点相差较大的液体混合物
3、下列物质分类或归纳正确的是
①.化合物:CaCl2、NaOH、H2、HBr ②.强电解质:BaSO4、KOH HI、K2CO3
③.混合物:盐酸、漂白粉、水银、空气 ④.同素异形体:金刚石与C60、红磷与白磷
⑤.放热反应:中和反应、铝与NaON溶液的反应、食物的缓慢氧化
⑥.酸性氧化物:P2O5、CO2、NO2、Al2O3
A.①③④ B.①②③④ C.②④⑤ D.①②④⑥
1、位于美国纽约港外一个海岛上的“自由女神”历来被认为是美国民主自由的象征,但据报道她现在“病”得相当严重。检查发现:由于时间长久,女神的铜外壳与雕象内支撑它的铁支架之间的毛毡己丧失了隔离作用,导致铁支架一层又一层地锈蚀,松蓬的氧化铁使支架体积膨胀,铆固的支架被撑断。对此现象的产生原因解释不正确的是
A.氧化铁的形成主要是因为铁铜及周围介质构成原电池导致的
B.生锈过程中可能发生的反应有:4Fe(OH)2+2H2O+O2=4Fe(OH)3
C.氧化铁的形成是因为铁与O2发生化学腐蚀
D.若是在干燥的环境中,女神可能会在更长时间内保持“健康状态”。
2、向下列分散系中滴加稀硫酸能产生沉淀,继续滴加稀硫酸,沉淀又溶解的是
A.Na2SiO3溶液 B.Ba(OH)2溶液
C.AlCl3溶液 D.Fe(OH)3胶体
26、(1)配平氧化还原反应方程式:
__ C2O42-+__MnO4-+__H+= __CO2+__Mn2++__H2O
(2)称取6.0 g含H2C2O4·2H2O、KHC2O4和K2SO4的试样,加水溶解,配成250mL溶液。量取两份此溶液各25mL,分别置于两个锥形瓶中。
①第一份溶液中加入酚酞试液,滴加0.25mol/LNaOH溶液至20mL时,溶液由无色变为浅红色。该溶液被中和的H+的物质的量为___mol。
②第二份溶液中滴加0.10mol/L的酸性高锰酸钾溶液至16mL时反应完全,此时溶液颜色由__变为__。该溶液中还原剂的物质的量为___mol。
③原试样中H2C2O4·2H2O的质量分数为___。KHC2O4的质量分数为___。
广元中学2010届高三第三次月考
25.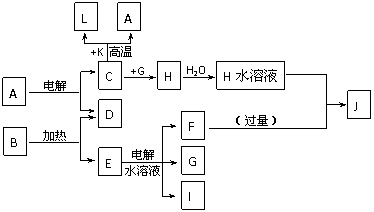 (10分) A-J分别代表中学化学中常见的一种单质或化合物,其转化关系如图。
(10分) A-J分别代表中学化学中常见的一种单质或化合物,其转化关系如图。
已知A在工业上常用作耐火材料,C、D、G、I为短周期元素形成的单质,D、G、I常温下为气态;形成D的元素的原子最外层电子数是次外层的3倍;B在焰色反应中呈紫色(透过蓝色钴玻璃),L是目前应用最广泛的金属。请回答下列问题:
(1)若K为红棕色粉末,写出C与K反应的化学方程式____________________________,引发该反应的操作为_____________________________________________________
 __________________________________________________________。
__________________________________________________________。
(2)写出电解E水溶液的化学方程式__________________________________________。
(3)J与H反应的离子方程式为_________________________________。若在上述转化关系中每一步反应均为恰好反应,且不考虑C+K→A+L的变化时,为了最终得到J,则A、B的物质的量之比为_____________。
24.(12分)现有A、B、C、D、E五种强电解质,它们在水中可电离产生下列离子(各种离子不重复)。
|
阳离子 |
H+、Na+、A13+、Ag+、Ba2+ |
|
阴离子 |
OH-、C1-、CO32-、NO3-、SO42- |
已知:①A、B两溶液呈碱性;C、D、E溶液呈酸性。
②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有气体产生(沉淀包括微溶物,下同)。
③D溶液与另外四种溶液反应都能产生沉淀; C只能与D反应产生沉淀。
试回答下列问题:
(1) 写出化学式:A___________ B___________ D_________
(2) E溶液呈酸性的原因是:(用离子方程式表示)_______________________________
(3 ) 将C溶液逐滴加入等体积、等物质的量浓度的A溶液中,反应后溶液中各种离子浓度由大到小的顺序为: 。
(4 )在100mL0.1mol·L-1 E溶液中,逐滴加入35mL 2mol·L-1NaOH溶液,最终得到沉淀物质的量为 mol
23.某同学在配制NaOH溶液时有以下现象发生,则对所配溶液的物质的量浓度有何影响?(填偏高、偏低或不变)
(1)定容时仰视 .
(2)NaOH颗粒表面部分变质 .
(3)未将烧杯的洗液注入容量瓶 .
(4)用胶头滴管向容量瓶中加水时凹面高于刻度线.此时立即用胶头滴管将瓶内液体吸出,使凹液面与刻度线相切 .
(5)容量瓶未干燥 .
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com