
题目列表(包括答案和解析)
29、(12分) 卤代烃分子里的卤原子与活泼金属的阳离子结合发生下列反应(X代表卤原子):
R-X+2Na+X-R′→R-R′+2NaX

根据下列各物质的转化关系:
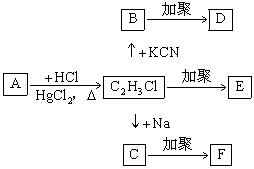
其中D为一种合成纤维,E为一种合成塑料,F为一种合成橡胶。填写下列空白:
(1)A的分子式是_________,E的结构简式是_________。
(2)B→D的化学方程式(不必注明反应条件,但是要配平)是_________。
(3)C→F的化学方程式(不必注明反应条件,但是要配平)是_________。
28.(15分)甲、乙两个实验小组分别进行“测定Na2CO3和NaCl混合物中Na2CO3含量”的实验。
(1)甲组:沉淀分析法
把一定量的混合物溶解后加入过量CaCl2,然后将所得沉淀过滤、洗涤、烘干、称量。确定CaCl2溶液是否过量的方法是__________________ ______,洗涤沉淀并判断沉淀是否洗净的操作是___________ ______
_____________________________________________________________。
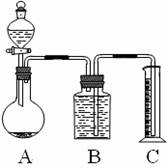 (2)乙组:气体分析法
(2)乙组:气体分析法
把一定量的混合物与足量盐酸反应后,用如图装置测定产生的CO2气体的体积,为减小CO2的溶解,
B中溶液应是_________________,选用该溶液后
实验结果还是不准确,原因是_________________
___________________________。
(3)请你设计一个与甲、乙两组操作不同的实验方案,
测定混合物中Na2CO3的含量。
方法:______________________________ __。
27.(15分)有一瓶澄清的溶液,其中可能含NH4+、K+、Na+、Mg2+、Al3+、Fe3+、CO32-、I-中的一种或几种,取该溶液进行如下实验:
①用PH试纸检验,表明溶液呈强酸性。
②取部分溶液,加入少量的CCl4及数滴新制的氯水,振荡后CCl4层显紫色。
③另取部分溶液,逐滴加入稀NaOH溶液,使溶液从酸性逐渐转变为碱性,在滴加过程中及滴加完毕后,溶液中均无沉淀生成。
④将③得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。
根据上述实验事实确定并回答:
(1)在溶液中,肯定存在的有________,肯定不存在的离子有_______________。
(2)写出实验②③中的离子反应方程式_________ __________、
_ ___ _____________________。
(3)不能确定是否存在的离子有__________________________。
26.(18分)A、B、C、D四种短周期元素的原子序数依次增大。A、D同族,B、C同周期。A、B组成的化合物甲为气态,其中A、B原子数之比为4:1。由A、C组成两种化合物乙和丙均为液态,乙中A、C原子数之比为1:1,丙中为2:1;由D、C组成的两种化合物丁和戊均为固态,丁中原子数比为1:1,戊中2:1。(已知:C为氧元素)。
⑴写出化学式:甲 乙 丙
丁 戊 。
⑵写出B元素的最高价氧化物跟丁发生反应的化学方程式
。
13.微观粒子是化学研究的主要对象。若阿伏加德罗常数为6.02×1023mol-1,下列对粒子数判断正确的是 ( )
A.常温常压下,2.24L CO2气体中含有的分子数为0.1×6.02×1023

 B.2.8g [CH2-CH2
]n 中含有的碳原子数为0.2×6.02×1023
B.2.8g [CH2-CH2
]n 中含有的碳原子数为0.2×6.02×1023
C.0.3L 1mol/L Na2SO4 溶液中含有的Na+数为0.3×6.02×1023
D.1.7gNH3中含有的质子数为0.4×6.02×1023
非选择题
12.许多国家十分重视海水资源的综合利用。不需要化学变化就能够从海水中获得的物质是 ( )
A.氯气、液溴、碘单质 B.钠、镁、铝的单质
C.烧碱、氢气 D.食盐、淡水
11.对下列各种溶液中所含离子的判断合理的是 ( )
A.向无色溶液中加氯水变橙色,溶液中可能含:SO42-,Br-,OH-,Ba2+
B.在c(H+)=10-14mol/L的溶液中可能含:Na+,AlO2-,CO32-,SO32-
C.某溶液,加铝粉有氢气放出,则溶液中可能含:K+,Na+,H+,NO3-
D.使紫色石蕊试液变红色的溶液中可能含:K+,Na+,Ca2+,HCO3-
9.下列离子方程式正确的是 ( )
A.二氧化硅与氢氧化钠溶液反应:SiO2+2OH- SiO32-+H2O
B.碳酸钙与盐酸反应:CO32-+2H+ CO2↑+H2O
C.硫酸与氢氧化钡溶液反应:Ba2++OH-+H++SO42- BaSO4↓+H2O
D.氯气通入冷的氢氧化钠溶液中 2Cl2 + 2OHˉ = 3Clˉ + ClOˉ + H2O
|
A.①和② B.只有② C.②和③ D.只有③
8.用食用白醋(醋酸浓度约1 mol/L)进行下列实验,能证明醋酸为弱电解质的是 ( )
A.白醋中滴入石蕊试液呈红色 B.白醋加入水玻璃中有沉淀产生
C.蛋壳浸泡在白醋中有气体放出 D.pH试纸显示白醋的pH为2-3
7.下列关于干电池的描述错误的是 ( )
A.最早的干电池是锌锰电池
B.普通干电池可以多次充电反复使用
C.普通锌锰干电池在使用过程中外壳逐渐变薄是因为:Zn →Zn2+ +2e-
D.普通干电池是一种将化学能转变成电能的装置
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com