
题目列表(包括答案和解析)
29.氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:
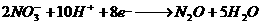
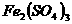 、
、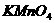 、
、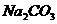 、
、
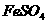 四种物质中的一种物质能使上述还原过程发生。
四种物质中的一种物质能使上述还原过程发生。
(1)写出并配平该氧化还原反应的方程式: 。
(2)该反应中氧化剂和还原剂物质的量之比为 。
(3)反应中硝酸体现了 、 性质。
(4)反应中若产生0.1mol气体,则转移电子的物质的量是 mol.
|
阳离子 |
Cu2+、K+、Fe2+、H+ |
|
阴离子 |
SO42- 、OH- 、NO3- |
28.过氧化氢在催化剂作用下可快速产生氧气,它不仅是常用的消毒剂,还在航天和军事工业上有重要的用途。
(1)写出在过氧化氢溶液中加入MnO2粉末时,反应的化学方程式 。
(2)常用的消毒剂CH3COOOH(过氧乙酸),可以用冰醋酸和过氧化氢反应制取。制取时的化学反应方程式为 。该消毒剂中含有的少量过氧化氢,可以用它与高锰酸钾、次氯酸钠等强氧化剂的反应进行测定。请问,该消毒剂能否与漂粉精混合使用。
(3)过氧化氢和强还原剂液态肼(N2H4)可构成火箭推进剂。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热。已知0.4 rnol液态肼与足量的过氧化氢反应,生成氮气和水蒸气,放出236.64kJ的热量。
①写出该反应的热化学方程式 。
②又知H2O(l)====H2O(g);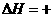 44
kJ·mol
44
kJ·mol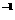 ,则16 g液态肼与过氧化氢反应生成液态水时放出的热量是
kJ。
,则16 g液态肼与过氧化氢反应生成液态水时放出的热量是
kJ。
③此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有-个很大的优点是
27.置换、化合、复分解是三种基本反应类型,而H2O在各种化学反应中扮演不同的“角色”。下面围绕水的各反应全部来自现行教材。下列问题所涉及的答案可能有多种,只需答出一种情况即可:
⑴H2O作反应物的置换反应
①________________________(填化学式)和H2O能在加热或高温条件下进行;
②产生O2的反应,其化学方程式:______________________________________;
⑵H2O作生成物的置换反应:
加热条件下的置换,其反应物可是_____________________________(填化学式);
 ⑶水解反应
⑶水解反应
①气体产物可用于焊接金属,其化学方程式:______________________________;
②1分子的_____________________(填名称)水解之后有2分子同种物质生成;
⑷H2O作反应物的化合反应:
①有含碱金属元素的物质参与的三种物质间的化合反应,其化学方程式:
______________________________________________________________;
①有电子得失且三种物质参与的化合反应,其产物的颜色与状态是
_____________________________。
13.下列各组离子在指定条件下,-定能大量共存的是( )
①能使红色石蕊试纸变蓝的溶液中:K+、Na+、CO32-、NO3-、AlO2-
②c(H+)=10-1mol/L的溶液中:Cu2+、Al3+、SO42-、NO3-
③能使碘化钾淀粉试纸变蓝的溶液中:Na+、NH4+、S2-、Br-
④水电离出的c(H+)=10-12mol/L的溶液中:Na+、Mg2+、Cl-、SO42-
⑤在加入铝粉能产生H2的溶液中:NH4+、Fe2+、SO42-、NO3-
⑥在含大量Fe3+的溶液中:NH4+、Na+、Cl-、SCN-
A.①② B.①③ C.②④ D.②⑤⑥
选择题答题表:
12. 某容器中发生一个化学反应,反应过程中存在As2S3、HNO3、H2SO4、NO、H3AsO4、H2O六种物质,已知As2S3是反应物之一。下列有关判断不正确的是( )
某容器中发生一个化学反应,反应过程中存在As2S3、HNO3、H2SO4、NO、H3AsO4、H2O六种物质,已知As2S3是反应物之一。下列有关判断不正确的是( )
A.该容器中发生了氧化还原反应
B.该反应中HNO3、H2O等物质是反应物,H2SO4、NO、H3AsO4是生成物
C.HNO3、H2SO4、H3AsO4都属于最高价氧化物的水化物
D.该反应中只有砷元素被氧化、只有氮元素被还原
11.下列反应的离子方程式正确的是( )
①硫酸铜溶液与氢氧化钡溶液反应:Ba2++SO42-=BaSO4↓
②将金属钠加入水中:2Na+2H2O=2Na++2OH-+H2↑
③石灰石溶于稀醋酸:CaCO3+2CH3COOH=2CH3COO-+Ca2++CO2↑+H2O
④氟气与水反应:F2+H2O=H++F-+HFO
⑤小苏打溶液中加入少量石灰水:Ca2++2OH- +2HCO3-=CaCO3↓+CO32-+2H2O
⑥次氯酸钙溶液中通入过量CO2: Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO
⑦钠与硫酸铜溶液反应: Cu2++2Na=Cu+2Na+
⑧氯气与水反应:Cl2+H2O=2H++Cl-+ClO-
⑨纯碱溶液中滴加少量盐酸: CO32-+H+= HCO3-
A.①②⑤⑨ B.⑨③⑤⑨ C.④⑤⑥⑦ D.②③⑧⑨
10.向足量H2SO4溶液中加入100mL 0.4 mol·L-1 Ba(OH)2溶液,放出的热量是5.12kJ。如果向足量Ba(OH)2溶液中加入100mL 0.4mol·L-1 HCl溶液时,放出的热量为2.292kJ。则Na2SO4溶液与BaCl2溶液反应的热化学方程式及中和热的有关叙述中正确的是( )
A.中和热△H=-57.3kJ·mol-1
B.稀的强酸与强碱反应的中和热为:△H=-128kJ·mol-1
C.Ba2+(aq)+SO42-(aq)=BaSO4(s);△H=-73kJ·mol-1
D.Ba2+(aq)+SO42-(aq)=BaSO4(s);△H=-13.4kJ·mol-1
9.2008北京市公交车全部使用绿色能源,将会大大减少有害汽车尾气排放量。乙醇是一种可再生的绿色能源,已知H2O(g)=H2O(l);△H1=-Q1 kJ/mol,C2H5OH(g)=C2H5OH(l);△H2=-Q2 kJ/mol C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g);△H3=-Q3 kJ/mol 若使23 g酒精液体完全燃烧,最后恢复到室温,则放出的热量(kJ)为( )
A.Q1+Q2+Q3 B.0.5(Q1+Q2+Q3);
C.0.5Q1-1.5Q2+0.5Q3 D.1.5Q1-0.5Q2+0.5Q3
8.已知:H2(g)+F2(g)= 2HF(g);△H=-270 kJ/mol,下列说法正确的是( )
A.2 L HF气体分解成1 L的H2和1 L的F2吸收270 kJ热量
B.1 mol H2与1 mol F2反应生成2 mol液态HF放出的热量小于270 kJ
C.在相同条件下,1 mol H2与1 mol F2的能量总和大于2 mol HF气体的能量
D.1个H2分子与1个F2分子反应生成2个HF分子放出270 kJ
7.下列各组离子,在溶液中能大量共存、加入NaOH溶液后加热既有气体放出又有沉淀生成的一组是( )
A.Ba2+、NO3-、NH4+、Cl- B.Ca2+、HCO3-、NH4+、AlO2-
C.K+、Ba2+、Cl-、HSO3- D.Mg2+、NH4+、SO42-、K+
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com