
题目列表(包括答案和解析)
9.下列说法正确的是 ( ) A .常温时,NaHCO3 溶液的pH 值比同浓度的CH3COONa 溶液小
B .常温时,pH=3的醋酸与pH=11的NaOH溶液等体积混合后,溶液呈碱性
C.把FeCl3 和FeCl2溶液分别蒸干并灼烧最后都得到Fe203 固体
D.常温下,在氨水中滴入稀盐酸使pH=7,则溶液中c(NH4+)<c(Cl–)
8.下列有关实验操作说法中,正确的是( )
① 用pH试纸测得氯水的pH为2
② 用量筒、试管、胶头滴管、玻璃棒、蒸馏水和pH试纸,可鉴别pH相等的硫酸和醋酸
③ 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
④ 用碱式滴定管量取25.00 mL溴水
⑤ 可用渗析的方法除去淀粉胶体中混有的少量的NaCl杂质
⑥ 在进行过滤操作时,为了加快速率,可用玻璃棒不断搅拌过滤器中液体
A.①③⑤ B.②③⑤ C.③④⑤ D.①③④⑥
7.将下列离子混合在同一溶液中,一定会产生沉淀的一组是( )
A.Na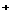 、Al
、Al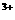 、Cl
、Cl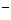 、OH
、OH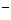 B.Ag
B.Ag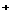 、NH
、NH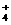 、NO
、NO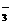 、OH
、OH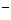
C.H3O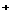 、Ca
、Ca 、CO
、CO 、NO
、NO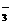 D.Na
D.Na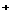 、Fe
、Fe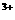 、Cl
、Cl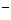 、CO
、CO
6.韩国首尔大学的科学家将水置于一个足够强的电场中,在20℃时,水分子瞬间凝固形 成“暖冰”。下列关于“暖冰”的说法中,正确的是( )
A.水分子是直线型的非极性分子
B.水凝固形成20℃时的“暖冰”所发生的变化是化学变化
C.水分子中各原子均满足8电子稳定结构
D.在电场作用下,水分子间更易形成氢键,因而可以制得“暖冰”
31.(16分)下图表示在不同条件下,某植物光合作用速率的变化曲线,请据图回答问题:
 (1)曲线A表明,光照强度较弱时,光合作
(1)曲线A表明,光照强度较弱时,光合作
 用速率较
(填大或小),原因是光反
用速率较
(填大或小),原因是光反
应阶段为暗反应阶段提供的 少。
 (2)光照强度为P时,导致曲线A.B差异
(2)光照强度为P时,导致曲线A.B差异
的因素是 __________________导致曲线B.C差异
 的因素是
,由b点到c点,
的因素是
,由b点到c点,
 植物叶绿体 中C3化合物的量在一定时间内会
,
植物叶绿体 中C3化合物的量在一定时间内会
,
原因是:

 减弱,而
仍在进行。
减弱,而
仍在进行。

29.(15分)已知芳香族化合物C的分子式为C9H9OCl。C分子中只有一条支链有一个甲基且不在苯环上;一定条件下C能发生银镜反应;C与其它物质之间的转化关系如下图所示:
回答下列问题:
(1)C→F的反应类型为 。
(2)高分子H的结构简式为 。
(3)B→A反应的化学方程式为 。
(4)D→E反应的化学方程式为 。
(5)D的一种同系物W(分子式为C8H8O2)的同分异构体很多,试写出符合以下条件的W的三种同分异构体的结构简式:
①属于芳香族化合物
②遇FeCl3溶液不变紫色
③能与NaOH溶液发生反应但不属于水解反应 、 、
。
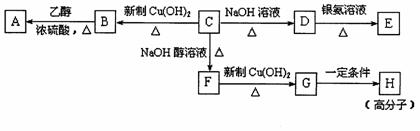
28.(14分)物质之间的转化关系如下图,其中A、D、E、F、H为常见的单质,且A为生活中常用的金属,其余的为化合物。单质E和单质F在点燃或加热的条件下生成淡黄色的固体,B常温下为液态化合物。

试回答下列有关问题:
(1)A在元素周期表的位置为 周期 族。
(2)以上7个化学反应属于非氧化还原反应的是 (用编号①→⑦填写)。
(3)写出反应②的化学方程式 。
(4)反应⑤的离子方程式是: 。
(5)工业上用电解熔融的J制H,电解时阴极的电极反应式为: 。
26.(15分)A、B、C、D、E为原子序数依次增大的五种短周期元素。E元素最高正价与最低负价的代数和为6,C单质既可与盐酸反应又可与NaOH溶液反应,C、E属同一周期,且能形成1:3型化合物;B原子的最外层电子数比次外层电子数多3;A、D原子序数相差8;若用A、B、D三种元素最高价氧化物分别与足量NaOH溶液反应,在得到的溶液中加入过量稀盐酸,只有一种溶液中能析出白色沉淀Y。
(1)写出E元素和钾元素形成的化合物的化学式 。
(2)C的氧化物与氢氧化钠溶液反应的离子方程式为 。
(3)将红热的A单质投入到B的最高价氧化物对应水化物浓溶液中发生反应的化学方程式为 。
(4)生成白色沉淀Y的离子方程式为 。
(5)在1molD的最高价氧化物形成的晶体中,含有共价键 mol。
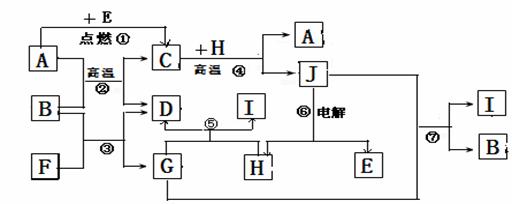
 27.(16分)在如图所示的装置中,由A处通入气体,试剂瓶中的现象为溶液先变浑浊,后又变澄清。
27.(16分)在如图所示的装置中,由A处通入气体,试剂瓶中的现象为溶液先变浑浊,后又变澄清。
(1)若试剂瓶中的溶液为某种碱溶液,则通入的气体为 或 。
(2)若试剂瓶中的溶液是显碱性的盐溶液,则通入的气体为 。离子方程式为 。
(3)若反应结束后,用洁净的试管取适量试剂瓶中的溶液,加入葡萄糖溶液,再水浴加热,生成银镜,则原试剂瓶中的溶液为 ,通入的气体为 。
(4)若试剂瓶中为BaCl2溶液,在A处先通入一种气体,无沉淀产生;继续通入另一种气体,则有白色沉淀产生,且B处有气体放出,放出的气体遇到空气变为红棕色,则先通入的气体为 ;生成的沉淀为 。
12.发射嫦娥一号卫星的运载火箭的第三级发动机使用低温燃料液氧和液氢。已知:1mol H-H键完全断裂需吸收436kJ能量,1molO=O键完全断裂需吸收能量496kJ,水蒸气中1molH-O键形成时放出能量463kJ。下列热化学反应方程式正确的是
A.2H2+O2=2H2O;△H=-1852kJ/mol
B.2H2(g)+O2(g)=2H2O(g);△H=-1852kJ/mol
C.2H2(g)+O2(g)=2H2O(g);△H=+484kJ/mol
D.2H2(g)+O2(g)=2H2O(g);△H=-484kJ/mol
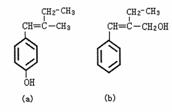 13.有a、b两种有机物,其结构简式如下所示:
13.有a、b两种有机物,其结构简式如下所示:
关于a、b两种有机物的下列说法中错误的是
A.鉴别a、b可用FeCl3溶液 B.a、b互为同分异构体
C.a、b均能与NaOH溶液反应 D.1mol a与浓溴水反应最多可消耗3mol Br2
非选择题
11.将1mol I2(g)和2mol H2(g)置于2L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)
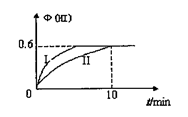
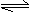 2HI(g);△H<0。10min后达到平衡,HI的体积分数Φ(HI)随时间变化如下图中曲线II所示。若改变反应条件,Φ(HI)的变化如图曲线I所示,则该条件可能是
2HI(g);△H<0。10min后达到平衡,HI的体积分数Φ(HI)随时间变化如下图中曲线II所示。若改变反应条件,Φ(HI)的变化如图曲线I所示,则该条件可能是
A.恒容条件下升高温度
B.恒温恒容条件下加入适当的催化剂
C.恒温条件下扩大反应容器的体积
D.增大反应物中H2的浓度
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com