
题目列表(包括答案和解析)
41. 在m mL b mol·L-1 AlCl3溶液中,加入等体积a mol·
在m mL b mol·L-1 AlCl3溶液中,加入等体积a mol· L-1的NaOH溶液。
L-1的NaOH溶液。





 (1)当a≤3b时,生成Al(OH)3沉淀的物质的量是________mol。
(1)当a≤3b时,生成Al(OH)3沉淀的物质的量是________mol。
 (2)当a、b满足________条件时,无沉淀生成。
(2)当a、b满足________条件时,无沉淀生成。
 (3)当a、b分别满足______________条件时,有沉淀生成且溶液中无Al3+存在,生成Al(OH)3沉淀的物质的量是________。
(3)当a、b分别满足______________条件时,有沉淀生成且溶液中无Al3+存在,生成Al(OH)3沉淀的物质的量是________。
40. 将0.1 mol的镁、铝混合物溶于100 mL 2mol/LH2SO4溶液中,然后再滴加1 mol/L NaOH
将0.1 mol的镁、铝混合物溶于100 mL 2mol/LH2SO4溶液中,然后再滴加1 mol/L NaOH
 溶液。请回答:
溶液。请回答:
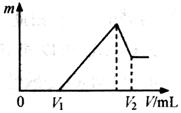
 ⑴若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如下图所示。当
⑴若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如下图所示。当
 V1=160mL时,则金属粉末中n(Mg)= mol,V2=
V1=160mL时,则金属粉末中n(Mg)= mol,V2=
 mL。
mL。
 ⑵若在滴加NaOH溶液过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶 液的体积V(NaOH) mL。
⑵若在滴加NaOH溶液过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶 液的体积V(NaOH) mL。
 ⑶若混合物仍为0.1 mol,其中Mg粉的物质的量分数为a,用100 mL 2 mol/L的硫酸溶解此混合物后,再加入450 mL 1mol/L的NaOH溶液,所得沉淀中无Al(OH)3。满足此条件的a的取值范围是: 。
⑶若混合物仍为0.1 mol,其中Mg粉的物质的量分数为a,用100 mL 2 mol/L的硫酸溶解此混合物后,再加入450 mL 1mol/L的NaOH溶液,所得沉淀中无Al(OH)3。满足此条件的a的取值范围是: 。
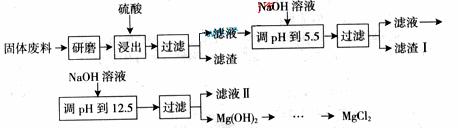
39. 某工厂生产硼砂过程中产生的固体废料,主要含有MgCO3、MgSiO3、 CaMg(CO3)2、Al2O3和Fe2O3等,回收其中镁的工艺流程如下:
某工厂生产硼砂过程中产生的固体废料,主要含有MgCO3、MgSiO3、 CaMg(CO3)2、Al2O3和Fe2O3等,回收其中镁的工艺流程如下:

|
沉淀物 |
Fe(OH)3 |
Al(OH)3 |
Mg(OH)2 |
|
PH |
3.2 |
5.2 |
12.4 |
 部分阳离子以氢氧化物形式完全深沉时溶液的pH由见上表,请回答下列问题:
部分阳离子以氢氧化物形式完全深沉时溶液的pH由见上表,请回答下列问题:
 (1)“浸出”步骤中,为提高镁的浸出率,可采取的措施有
(要求写出两条)。
(1)“浸出”步骤中,为提高镁的浸出率,可采取的措施有
(要求写出两条)。
 (2)滤渣I的主要成分有 。
(2)滤渣I的主要成分有 。
 (3)从滤渣Ⅱ中可回收利用的主要物质有
。
(3)从滤渣Ⅱ中可回收利用的主要物质有
。
 (4)Mg(ClO3)2在农业上可用作脱叶剂、催熟剂,可采用复分解反应制备:
(4)Mg(ClO3)2在农业上可用作脱叶剂、催熟剂,可采用复分解反应制备:
 MgCl2+2NaClO3===Mg(ClO3)2+2NaCl
MgCl2+2NaClO3===Mg(ClO3)2+2NaCl
 已知四种化合物的溶解度(S)随温度(T)变化曲线如下图所示:
已知四种化合物的溶解度(S)随温度(T)变化曲线如下图所示:






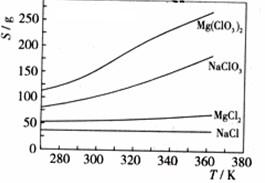
 ①将反应物按化学反应方程式计量数比混合制备Mg(ClO3)2。简述可制备Mg(ClO3)2的原因:
。
①将反应物按化学反应方程式计量数比混合制备Mg(ClO3)2。简述可制备Mg(ClO3)2的原因:
。
 ②按①中条件进行制备实验。在冷却降温析出Mg(ClO3)2过程中,常伴有NaCl析出,原因是:
。除去产品中该杂质的方法是:
。
②按①中条件进行制备实验。在冷却降温析出Mg(ClO3)2过程中,常伴有NaCl析出,原因是:
。除去产品中该杂质的方法是:
。
38. 金属铝的生产是以Al2O,为原料,在熔融状态下进行电解:
金属铝的生产是以Al2O,为原料,在熔融状态下进行电解:
 2Al2O3
2Al2O3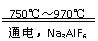
 4Al+3O2↑
4Al+3O2↑
 请回答下列问题:
请回答下列问题:
 (1)冰晶石(Na3AIF6)的作用是 。
(1)冰晶石(Na3AIF6)的作用是 。

 (2)电解生成的金属铝是在熔融液的 (填“上层”或“下层”)。
(2)电解生成的金属铝是在熔融液的 (填“上层”或“下层”)。
 (3)阴极和阳极均由 材料做成;电解时不断消耗的电极是 (填“阳极”或“阴极”)。
(3)阴极和阳极均由 材料做成;电解时不断消耗的电极是 (填“阳极”或“阴极”)。
 (4)铝是高耗能产品,废旧铝材的回收利用十分重要。在工业上,最能体现节能减排思想的是将回收铝做成
(填代号)。
(4)铝是高耗能产品,废旧铝材的回收利用十分重要。在工业上,最能体现节能减排思想的是将回收铝做成
(填代号)。
 a.冰晶石 b.氧化铝 c.铝锭 d.硫酸铝
a.冰晶石 b.氧化铝 c.铝锭 d.硫酸铝
37.


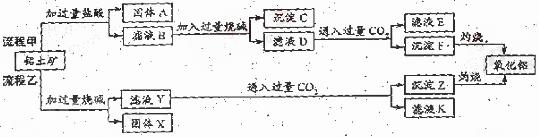
 从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取两种工艺品的流程如下:
从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取两种工艺品的流程如下:



 请回答下列问题:
请回答下列问题:






 (1)流程甲加入盐酸后生成Al3+的方程式为
。
(1)流程甲加入盐酸后生成Al3+的方程式为
。

 (2)流程乙加入烧碱后生成SiO32-的离子方程式为
。
(2)流程乙加入烧碱后生成SiO32-的离子方程式为
。

 (3)验证滤液B含Fe3+,可取少量滤液并加入
(填试剂名称)。
(3)验证滤液B含Fe3+,可取少量滤液并加入
(填试剂名称)。

 (4)滤液E、K中溶质的主要成份是 (填化学式),写出该溶液的一种用途 。
(4)滤液E、K中溶质的主要成份是 (填化学式),写出该溶液的一种用途 。

 (5)已知298K时,Mg(OH)2的容度积常数Ksp=5.6×10-12,取适量的滤液B,加入一定量的烧碱达到沉淀溶液平衡,测得pH=13.00,则此温度下残留在溶液中的c(Mg2+) =
。
(5)已知298K时,Mg(OH)2的容度积常数Ksp=5.6×10-12,取适量的滤液B,加入一定量的烧碱达到沉淀溶液平衡,测得pH=13.00,则此温度下残留在溶液中的c(Mg2+) =
。
36. 下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
族 周期 周期 |
IA |
|
0 |
|||||
|
1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
|
2 |
|
|
|
② |
③ |
④ |
|
|
|
3 |
⑤ |
|
⑥ |
⑦ |
|
|
⑧ |
|






 (1)④、⑤、⑥的原子半径由大到小的顺序为_________________________。
(1)④、⑤、⑥的原子半径由大到小的顺序为_________________________。
 (2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是_________________________。
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是_________________________。
 (3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:____________________。
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:____________________。
 (4)由表中两种元素的原子按1:1组成的常见液态化合物的稀液易被催化分解,可使用的催化剂为(填序号)_________________。
(4)由表中两种元素的原子按1:1组成的常见液态化合物的稀液易被催化分解,可使用的催化剂为(填序号)_________________。
 a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4
a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4
 (5)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
(5)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:






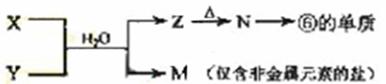
 X溶液与Y溶液反应的离子方程式为_____________________,
X溶液与Y溶液反应的离子方程式为_____________________,
 N→⑥的单质的化学方程式为________________。
N→⑥的单质的化学方程式为________________。
 常温下,为使0.1 mol/L M 溶液中由M电离的阴、阳离子浓度相等,应向溶液中加入一定量的Y溶液至_________________。
常温下,为使0.1 mol/L M 溶液中由M电离的阴、阳离子浓度相等,应向溶液中加入一定量的Y溶液至_________________。
35. 铝和氢氧化钾都是重要的工业产品。请回答:
铝和氢氧化钾都是重要的工业产品。请回答:





 (1)工业冶炼铝的化学方程式是
。
(1)工业冶炼铝的化学方程式是
。
 (2)铝与氢氧化钾溶液反应的离子方程式是
。
(2)铝与氢氧化钾溶液反应的离子方程式是
。
 (3)工业品氢氧化钾的溶液中含有某些含氧酸根杂质,可用离子交换膜法电解提纯。电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示。
(3)工业品氢氧化钾的溶液中含有某些含氧酸根杂质,可用离子交换膜法电解提纯。电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示。
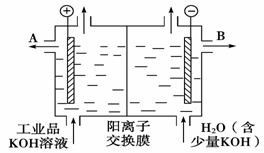






 ①该电解槽的阳极反应式是
。
①该电解槽的阳极反应式是
。





 ②通电开始后,阴极附近溶液pH会增大,请简述原因
。
②通电开始后,阴极附近溶液pH会增大,请简述原因
。
 ③除去杂质后的氢氧化钾溶液从液体出口
(填写“A”或“B”)导出。
③除去杂质后的氢氧化钾溶液从液体出口
(填写“A”或“B”)导出。
34. 下图中,A、C是工业上用途很广的两种重要化工原料,B为日常生活中常见的金属,
下图中,A、C是工业上用途很广的两种重要化工原料,B为日常生活中常见的金属,
 H、G是正四面体结构的非极性分子,H是一种重要的能源,J是一种耐高温材料,K是由
H、G是正四面体结构的非极性分子,H是一种重要的能源,J是一种耐高温材料,K是由
 两种常见元素组成的化合物(图中部分反应物或生成物没有列出)。请按要求回答:
两种常见元素组成的化合物(图中部分反应物或生成物没有列出)。请按要求回答:

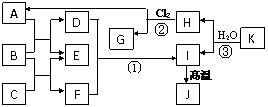 (1)写出B的化学式______________,
(1)写出B的化学式______________,
 G的电子式
。
G的电子式
。
 (2)反应①的离子方程式为_________________________________________________
(2)反应①的离子方程式为_________________________________________________
 (3)反应②进行的条件是________________________________________________
(4)反应③的化学方程式为 ______________________________________________
(3)反应②进行的条件是________________________________________________
(4)反应③的化学方程式为 ______________________________________________
33. 下图表示有关物质(均由短周期元素形成)之间的转化关系,其中A为常见的金属单
下图表示有关物质(均由短周期元素形成)之间的转化关系,其中A为常见的金属单
 质,B为非金属单质(一般是黑色粉末),C是常见的无色无味液体,D是淡黄色的固体化
质,B为非金属单质(一般是黑色粉末),C是常见的无色无味液体,D是淡黄色的固体化
 合物。(反应条件图中已省略。)
合物。(反应条件图中已省略。)

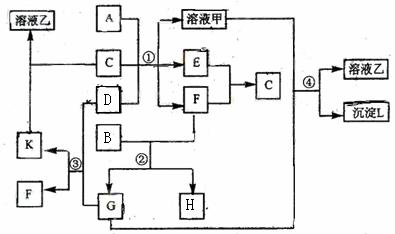
 (1)A、B、C、D代表的物质分别为 、 、
、 (填化学式);
(1)A、B、C、D代表的物质分别为 、 、
、 (填化学式);
 (2)反应①中的C、D均过量,该反应的化学方程式是
;
(2)反应①中的C、D均过量,该反应的化学方程式是
;
 (3)反应②中,若B与F物质的量之比为4∶3,G、H分别是 、 (填化学式);
(3)反应②中,若B与F物质的量之比为4∶3,G、H分别是 、 (填化学式);
 (4)反应③产物中K的化学式为
;
(4)反应③产物中K的化学式为
;
 (5)反应④的离子方程式为
。
(5)反应④的离子方程式为
。
32. 现拟在实验室里利用空气和镁粉为原料制取少量氮化镁(Mg3N2)。已知实验中可能会发生下列反应:
现拟在实验室里利用空气和镁粉为原料制取少量氮化镁(Mg3N2)。已知实验中可能会发生下列反应:
 ①2Mg+O2
①2Mg+O2 2MgO;②3Mg+N2
2MgO;②3Mg+N2  Mg3N2;③2Mg+CO2
Mg3N2;③2Mg+CO2 2MgO+C;
2MgO+C;
 ④Mg+H2O
④Mg+H2O MgO+H2↑;⑤Mg3N2 +6H2O
=3Mg(OH)2↓+2NH3↑
MgO+H2↑;⑤Mg3N2 +6H2O
=3Mg(OH)2↓+2NH3↑
 可供选择的装置和药品如下图所示(镁粉、还原铁粉均已干燥,装置内所发生的反应是完全的,整套装置的末端与干燥管相连)。
可供选择的装置和药品如下图所示(镁粉、还原铁粉均已干燥,装置内所发生的反应是完全的,整套装置的末端与干燥管相连)。

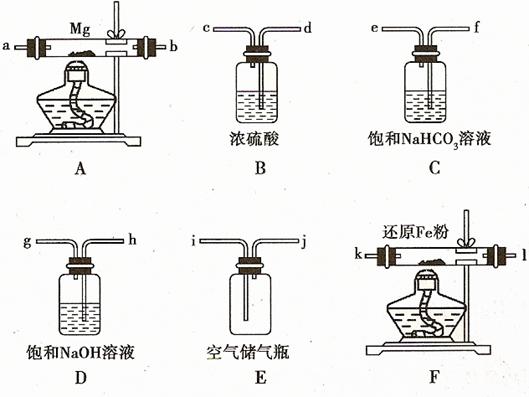
 回答下列问题;
回答下列问题;





 (1)在设计实验方案时,除装置A、E外,还应选择的装置(填字母代号)及其目的分别
。
(1)在设计实验方案时,除装置A、E外,还应选择的装置(填字母代号)及其目的分别
。

 (2)连接并检查实验装置的气密性。实验开始时,打开自来水的开关,将空气从5升的储气瓶压入反应装置,则气流流经导管的顺序是(填字母代号)
。
(2)连接并检查实验装置的气密性。实验开始时,打开自来水的开关,将空气从5升的储气瓶压入反应装置,则气流流经导管的顺序是(填字母代号)
。
 (3)通气后,如果同时点燃A、F装置的酒精灯,对实验结果有何影响?
,原因是
。
(3)通气后,如果同时点燃A、F装置的酒精灯,对实验结果有何影响?
,原因是
。
 (4)请设计一个实验,验证产物是氮化镁:
。
(4)请设计一个实验,验证产物是氮化镁:
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com