
题目列表(包括答案和解析)
7. 某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应A(g)+xB(g)
某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应A(g)+xB(g)
 2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的如下图所示。下列说法中正确是(
)
2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的如下图所示。下列说法中正确是(
)
A.30min时降低温度,40min时升高温度
B.8min前A的平均反应速率为0.08mol/(L·s)
C.反应方程式中的x=1,正反应为吸热反应
D.20min-40min间该反应的平衡常数均为4
6.某酸性溶液中只有Na+、CH3COO-、H+、OH-四种离子。则下列描述正确的是( )
A.该溶液可由pH=3的CH3COOH与pH=11的NaOH溶液等体积混合而成
B.该溶液由等物质的量浓度、等体积的NaOH溶液和CH3COOH溶液混合而成
C.加入适量的NaOH,溶液中离子浓度为c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
D.加入适量氨水,c(CH3COO-)一定大于c(Na+)、c(NH4+)之和
5.用下列实验装置完成对应的实验,能达到实验目的的是 ( )

4.已知下列反应的热化学方程式为:
⑴C(s)+O2(g)=CO2(g) ΔH 1=-393.5kJ/mol
⑵CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ΔH 2=-870.3kJ/mol
⑶H2(g)+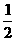 O2(g)=H2O(l) ΔH 3=-285.8kJ/mol
O2(g)=H2O(l) ΔH 3=-285.8kJ/mol
则反应2C(s)+2H2(g)+O2(g)=CH3COOH(l) 的反应热(焓变)为 ( )
A.+488.3 kJ/mol B.-488.3 kJ/mol
C.-244.15 kJ/mol D.+244.15 kJ/mol
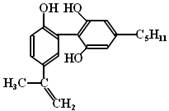
3.举办“人文奥运”的一个重要体现就是禁止运动员服用兴奋剂。有一种兴奋剂的结构简式如右式,下列有关该物质的说法正确的是 ( )
A.该分子中所有碳原子可以稳定的共存在一个平面中
B.遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物
C.1mol该物质与浓溴水和H2反应时,最多消耗Br2和H2的物质的量分别为4mol、7mol
D.滴入酸性KMnO4溶液,观察到紫色褪去,可证明分子中存在双键
2.下列各组离子一定能大量共存的是( )
A.在含有大量AlO2-的溶液中:NH4+、Na+、Cl-、H+
B.在强碱溶液中:Na+、K+、CO32-、NO3-
C.在pH=12的溶液中:NH4+、Na+、SO42-、Cl-
D.在c(H+)=0.1mol·L-1的溶液中:K+、I-、Cl-、NO3-
1.广口瓶被称为气体实验的“万能瓶”,是因为它可以配合玻璃管和其它简单仪器组成各种功能的装置。下列各图中能用作防倒吸安全瓶的是 ( )

42. 答案:(1)2.6g(2)1.335g(3)130mL
答案:(1)2.6g(2)1.335g(3)130mL
 解析:由图可知,NaOH、MgCl2、AlCl3三种固体溶于水时,NaOH过量,0.58g沉淀为Mg(OH)2,10mL盐酸用于中和过量NaOH,30mL-10mL=20mL盐酸和AlO2-反应生成Al(OH)3;最后加入的盐酸溶解Mg(OH)2和Al(OH)3沉淀。
解:(1)由
解析:由图可知,NaOH、MgCl2、AlCl3三种固体溶于水时,NaOH过量,0.58g沉淀为Mg(OH)2,10mL盐酸用于中和过量NaOH,30mL-10mL=20mL盐酸和AlO2-反应生成Al(OH)3;最后加入的盐酸溶解Mg(OH)2和Al(OH)3沉淀。
解:(1)由




 MgCl2+2NaOH===Mg(OH)2↓+2NaCl
0.02mol
MgCl2+2NaOH===Mg(OH)2↓+2NaCl
0.02mol 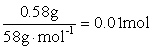 NaOH + HCl == NaCl + H2O
0.005mol 0.01L×0.5mol/L
AlO2- + H+ + H2O == Al(OH)3↓
0.01mol 0.02L×0.5mol/L 0.01mol
AlCl3 + 4NaOH == NaAlO2 + 3NaCl
0.01mol 0.04mol 0.01mol
由上述可知,n(NaOH)=0.02mol+0.005mol+0.04mol=0.065mol
所以m(NaOH)=0.065mol×40g/mol=2.6g
(2)由(1)可知,n(AlCl3)=0.01mol 所以m(AlCl3)=0.01mol×133.5g/mol=1.335g
(3)由图知:P点溶液的溶质为NaCl、AlCl3、MgCl2,相当于用盐酸中和了原溶液中的NaOH所得的结果,所以n(HCl)=n(NaOH)=0.065mol,
NaOH + HCl == NaCl + H2O
0.005mol 0.01L×0.5mol/L
AlO2- + H+ + H2O == Al(OH)3↓
0.01mol 0.02L×0.5mol/L 0.01mol
AlCl3 + 4NaOH == NaAlO2 + 3NaCl
0.01mol 0.04mol 0.01mol
由上述可知,n(NaOH)=0.02mol+0.005mol+0.04mol=0.065mol
所以m(NaOH)=0.065mol×40g/mol=2.6g
(2)由(1)可知,n(AlCl3)=0.01mol 所以m(AlCl3)=0.01mol×133.5g/mol=1.335g
(3)由图知:P点溶液的溶质为NaCl、AlCl3、MgCl2,相当于用盐酸中和了原溶液中的NaOH所得的结果,所以n(HCl)=n(NaOH)=0.065mol, 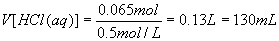










41. 答案:(1)
答案:(1)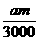 (2)a≥4b (3)3b<a<4b (4mb-ma)×10-3 mol
(2)a≥4b (3)3b<a<4b (4mb-ma)×10-3 mol
 解析:(1)当a≤3b时,AlCl3足量,生成Al(OH)3的量由NaOH溶液确定。
解析:(1)当a≤3b时,AlCl3足量,生成Al(OH)3的量由NaOH溶液确定。
 Al3+ + 3OH- ==== Al(OH)3↓
Al3+ + 3OH- ==== Al(OH)3↓
 3
1
3
1
 m×10-3×a mol x
m×10-3×a mol x
 x=
x=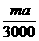 mol
mol
 (2)Al3+
+ 4OH-====AlO
(2)Al3+
+ 4OH-====AlO +2H2O
+2H2O
 1 4
1 4
 mb×10-3 mol ma×10-3 mol
mb×10-3 mol ma×10-3 mol
 所以4mb≤1ma a≥4b
所以4mb≤1ma a≥4b
 (3)当3b<a<4b,Al(OH)3沉淀达到最大值后,又溶解,溶液中无Al3+存在。
(3)当3b<a<4b,Al(OH)3沉淀达到最大值后,又溶解,溶液中无Al3+存在。
 n(Al(OH)3)=[mb-(ma-3mb)]×10-3 mol=(4mb-ma)×10-3 mol
n(Al(OH)3)=[mb-(ma-3mb)]×10-3 mol=(4mb-ma)×10-3 mol
40. 答案:⑴0.06 mol,440 mL。⑵400 mL。 ⑶
答案:⑴0.06 mol,440 mL。⑵400 mL。 ⑶ ≤a<1。
≤a<1。





 解析:⑴由图像可知:V1 mL的NaOH溶液是与过量H2SO4反应的,则与Mg、
解析:⑴由图像可知:V1 mL的NaOH溶液是与过量H2SO4反应的,则与Mg、
 Al反应的为H2SO4:0.2mol-0.16mol×=0.12mol。
Al反应的为H2SO4:0.2mol-0.16mol×=0.12mol。
 假设n(Mg)=x mol,n(Al)=y mol,
假设n(Mg)=x mol,n(Al)=y mol,
 则有方程组: 解得:
则有方程组: 解得:
 当加入V2 mL
NaOH溶液时,得到Mg(OH)2↓和NaAlO2,关系式为:
当加入V2 mL
NaOH溶液时,得到Mg(OH)2↓和NaAlO2,关系式为:
 Mg2+-2OH-,Al3+-4OH-,
Mg2+-2OH-,Al3+-4OH-,
 得:V2=160 mL+
得:V2=160 mL+ =440 mL。
=440 mL。
 ⑵当Mg2+、Al3+刚好沉淀完全时,溶液中只有Na2SO4,
⑵当Mg2+、Al3+刚好沉淀完全时,溶液中只有Na2SO4,
 关系式为2NaOH-H2SO4,得:V(NaOH)=
关系式为2NaOH-H2SO4,得:V(NaOH)=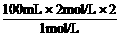 =400 mL。
=400 mL。
 ⑶当所得沉淀中无Al(OH)3时,NaOH溶液过量,反应后生成的溶质为:Na2SO4、NaAlO2。则根据Na元素守恒有:
⑶当所得沉淀中无Al(OH)3时,NaOH溶液过量,反应后生成的溶质为:Na2SO4、NaAlO2。则根据Na元素守恒有:
 n(NaOH)=0.45 L×1mol/L≥0.1 L×2
mol/L×2+0.1×(1-a)mol。
n(NaOH)=0.45 L×1mol/L≥0.1 L×2
mol/L×2+0.1×(1-a)mol。
 解得a≥
解得a≥ ,则满足此条件的a的取值范围是
,则满足此条件的a的取值范围是 ≤a<1。
≤a<1。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com