
题目列表(包括答案和解析)
12.下列实际应用与盐的水解知识无关的是( )
A.焊接时用NH4Cl溶液除锈
B.泡沫灭火器中用硫酸铝与饱和小苏打溶液
C.饱和氯化铁溶液滴入沸水制备Fe(OH)3胶体
D.生活中电解食盐水制取消毒液
11. 下列各溶液中,微料的物质的量浓度关系正确的是( )
下列各溶液中,微料的物质的量浓度关系正确的是( )
A.0.1mol/L的醋酸钠溶液20mL与0.1mol/L的盐酸10mL混合后溶液显酸性c(CH3C00-)>c(Cl-)>c(H+)>c(CH3COOH)
B.已知酸性HF>CH3COOH, 则pH相等的NaF与CH3COOK溶液中:
[c(Na+)-c(F-)]=[c(K+)-c(CH3COO-)]
C.0.1mol/L的醋酸的PH=a, 0.01mol/L的醋酸PH=b,则a+1=b
D.c(NH4+)相等的(NH4)2SO4溶液、(NH4)2CO3溶液和NH4Cl溶液:
C(NH4Cl)<c[(NH4)2CO3]<c[(NH4)2SO4]
10.下列叙述正确的是( )
A.物质的量浓度相等的 H2S 和 NaHS 混合溶液中:
c (Na+) +c(H+) = c (S2-―) +c (HS-―)+c (OH-―)
B.相同物质的量浓度的下列溶液中,①NH4Al(SO4)2、②NH4Cl、③CH3COONH4、④NH3·H2O;c(NH4+) 由大到小的顺序是:①>②>③>④
C.某二元酸(H2A)在水中的电离方程式是:H2A=H++HA-,HA-
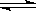 H++A2-;则在NaHA溶液中:c(Na+)
= c(A2-)+c(HA-)+c(H2A)
H++A2-;则在NaHA溶液中:c(Na+)
= c(A2-)+c(HA-)+c(H2A)
D.pH=12氨水溶液与pH=2盐酸溶液等体积混合: c(Cl-)>c(NH4+)>c(H+)>c(OH-)
9.今有室温下四种溶液:①pH=11的氨水、②pH=11的NaOH溶液、③Ph=3的醋酸、④pH=3的硫酸。下列有关说法中不正确的是( )
A.①、②中分别加入适量的氯化铵晶体后,两溶液的pH均减小
B.分别加水稀释10倍,四种溶液的pH大小顺序为①>②>④>③
C.①、④两溶液混合后,若溶液呈中性,则所得溶液中2c(N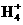 )=c(S
)=c(S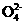 )
)
D.V1 L④与V2L②溶液混合后,若混合后溶液pH=4,则VI:V2=11:9
8.下列溶液中离子浓度的关系一定正确的是( )
A.Na2CO3和NaHCO3溶液中:
c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-)
B.一元弱碱MOH对应的盐MCl溶液中:
c(Cl-)>c(H+)>c(M+)>c(OH-)
C.等物质的量的一元弱酸HX与其钾盐KX的混合溶液中:
2c(K+)=c(X-)+c(HX)
D.pH=3的一元酸HX和pH=11的一元碱MOH等体积混合:
c(M+)=c(X-)>c(H+)=c(OH-)
7. 用0.10 mol·L-1的盐酸滴定0.10 mol·L-1的氨水,滴定过程中不可能出现的结果是( )
用0.10 mol·L-1的盐酸滴定0.10 mol·L-1的氨水,滴定过程中不可能出现的结果是( )
 A.c(NH4+)>c(Cl-),c(OH-)>c(H+)
A.c(NH4+)>c(Cl-),c(OH-)>c(H+)
 B.c(NH4+)=c(Cl-),c(OH-)=c(H+)
B.c(NH4+)=c(Cl-),c(OH-)=c(H+)
 C.c(Cl-)> c(NH4+), c(OH-)>c(H+)
C.c(Cl-)> c(NH4+), c(OH-)>c(H+)
 D.c(Cl-)> c(NH4+),c(H+)> c(OH-)
D.c(Cl-)> c(NH4+),c(H+)> c(OH-)
6.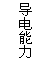
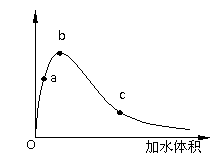 一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液
一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液
的导电能力变化如右图所示,下列说法不正确的是( )
A.a、b、c三点溶液的pH:c>a>b
B.a、b、c三点醋酸的电离程度:a<b<c
C.用湿润的pH试纸测量a处溶液的pH,测量结果偏小
D.a、b、c三点溶液用1mol/L氢氧化钠溶液中和,消耗
氢氧化钠溶液体积:c<a<b
30.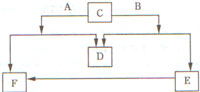 (18分)在A~F六种物质中,已知D是单质,其他均是中学化学常见的化合物。且已知在高压放电的条件下,D单质能够转化生成该元素的另外一种单质,A、B两种物质摩尔质量的关系为:M(A)<M(B)。它们之间的转化关系如图所示。
(18分)在A~F六种物质中,已知D是单质,其他均是中学化学常见的化合物。且已知在高压放电的条件下,D单质能够转化生成该元素的另外一种单质,A、B两种物质摩尔质量的关系为:M(A)<M(B)。它们之间的转化关系如图所示。
(1)B的电子式为 ,它属于 分子(填“极性”或“非极性”)。
(2)A与C反应时的离子方程式为
(3)通常工业生产中,实现E→F转化的化学方程式是 。
(4)根据以下常见化学实验装置或仪器回答有关问题。
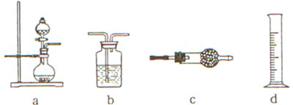
①若要实现B+C→D+E的反应,应选择装置 作为反应装置。
②若要实现A+C→D+F的反应,应选择装置 作为反应装置;若要用浓硫酸干燥该反应产生的气体,应用装置 作为干燥装置;为了测定该反应产生气体的体积,可用b、d组合成为量气装置,所量取的气体应从b装置的 (填“长管”或“短管”)通入b装置。为了使所量取气体体积准确,操作量气装置时的注意事项有 _______________________
_______________________________________________________________ .
29.(16分)为测定某含有杂质Na2O的Na2O2样品的纯度,3个小组分别设计如下方案。首先准确称量样品mg,然后,按照以下方案进行实验,请你完成相关内容:
[方案一]:将样品与水充分反应,使产生的O2通过灼热的铜粉,测得反应后生成氧化铜的质量为ng,通过计算求出试样中Na2O2的含量。Na2O2跟水反应的离子方程式是: ;根据所给数据计算出的试样中Na2O2含量的代数式为 。
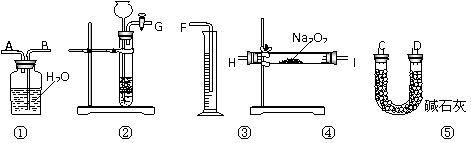 [方案二]:将样品与二氧化碳反应,通过测定反应产生氧气的体积,计算出样品中Na2O2的含量。
[方案二]:将样品与二氧化碳反应,通过测定反应产生氧气的体积,计算出样品中Na2O2的含量。
 (1)上图是完成该实验可能用到的实验装置,根据此实验方案,实验所使用仪器的连接次序是 。(填写仪器编号)
(1)上图是完成该实验可能用到的实验装置,根据此实验方案,实验所使用仪器的连接次序是 。(填写仪器编号)
(2)装置①⑤的作用分别是:① ⑤ 。
[方案三]:测定样品与水充分反应后溶液的体积VmL。,再从中取V1mL溶液装入锥形瓶中,用标准浓度的盐酸进行滴定,确定溶液的浓度,再计算出样品中Na2O2的含量。
(1)方案中酸碱滴定时,选用的滴定管为右图中的 (填仪器编号)。
(2)若用酚酞做指示剂,达到滴定终点时的现象为 。
(3)三个方案相比测定结果最准确的是 。
28.(18分)根据以下各物质间的转化关系回答有关问题。
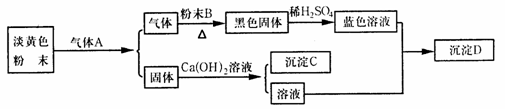
(1)B、C、D的化学式依次为_____________、___________、____________。
(2)A的电子式为_______,它属于___________(填“极性”或“非极性”)分子。
(3)淡黄色粉末与气体A反应的化学方程式为___________________________;黑色固体与稀硫酸反应的离子方程式为_________________________________。
(4)右图为中学化学实验室常用的部分装置或仪器,请填写有关空白。
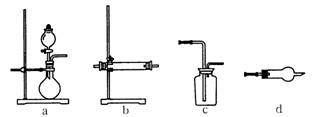 ①淡黄色粉末与气体A的反应,可以选择在上述装置_______
①淡黄色粉末与气体A的反应,可以选择在上述装置_______
(填字母代号,下同)中进行;气体与粉末B的反应可选用上述装置中的_______作反应发生装置。
②实验室通常用沉淀C和_______________反应制取气体A;制取时的反应装置应选用上述装置中的______________;若要用浓硫酸干燥制得的气体A,应选用上述装置中的__________作干燥装置。
③请写出装置d在中学化学实验中的可能用途(写出两条即可)______________
________________________________________________________________________________________________________________________________________.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com