
题目列表(包括答案和解析)
10.如图所示的装置,通电一段时间后,测得甲池中某电极质量增加2.16g, 乙池中某电极上析出0.24g某金属,下列说法正确的是( )
A.甲池是b极上析出金属银,乙池是c极上析出某金属
B.甲池是a极上析出金属银,乙池是d极上析出某金属
C.某盐溶液可能是CuSO4溶液 D.某盐溶液可能是Mg(NO3)2溶液
 11.下图中甲、乙两个装置用导线连接,有关叙述正确的是( )
11.下图中甲、乙两个装置用导线连接,有关叙述正确的是( )



 A.甲装置中Cu为阳极,乙装置Fe为负极
A.甲装置中Cu为阳极,乙装置Fe为负极
B.甲装置中SO2-4向Cu极移动,乙装置中的Na+向石墨极移动
C.乙烧杯中Fe极的电极反应式为:2H2O+2e-=2OH-+H2↑
D.当石墨电极上产生11.2L(标准状况)气体时,消耗Zn的质量为65g
9. 下图两个装置中,液体体积均为200 mL,开始工作前电解质溶液的浓度均为0.5 mol/L,工作一段时间后,测得有0.02 mol电子通过,若忽略溶液体积的变化,下列叙述正确的是( )
下图两个装置中,液体体积均为200 mL,开始工作前电解质溶液的浓度均为0.5 mol/L,工作一段时间后,测得有0.02 mol电子通过,若忽略溶液体积的变化,下列叙述正确的是( )
A.产生气体体积 ①=②
B.①中阴极质量增加,②中正极质量减小
C.电极反应式:①中阳极:4OH- - 4e- = 2H2O+O2↑②中负极:2H++2e-=H2↑
 D.溶液的pH变化:①减小,②增大
D.溶液的pH变化:①减小,②增大
8.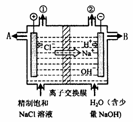 下图是工业电解饱和食盐水的装置示意图,下列有关说法不正确的是( )
下图是工业电解饱和食盐水的装置示意图,下列有关说法不正确的是( )
A.装置中的离子交换膜只能让阳离子通过,不能让阴离子通过
B.装置中出口①处的物质是氢气,出口②处的物质是氯气
C.除去杂质后的氢氧化钠溶液从出口B处导出
D.转移电子0.8 mol时产生氢气8.96 L(标准状态)
7.下列有关水的电解实验的说法中不正确的是( )
A.为提高水的电解速率,可以在水中加入少量的氯化钠
B.若在水中加入少量的硫酸钠,电解结束后溶液的pH将会保持不变
C.电解过程中,阴极区附近的溶液会使酚酞试液变红
D.当电解产生氧气1.12 L(标准状况)时,转移的电子总数为0.2mol
6.下列叙述正确的是( )
A.在原电池的负极和电解池的阴极上都是发生失电子的氧化反应
B.用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1∶2
C.用惰性电极电解饱和NaCl溶液,若有1 mol电子转移,则生成1 mol NaOH
D.镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀
30.I.完成下列离子方程式(给出物质的计量数不能改变)
(1) +6H+=2Fe3++3
(2) +Ca2++2 =CaCO3↓+
II.常温下有浓度均为0.5mol/L的五种溶液:①NaHCO3;②C6H5ONa;③ NH4HCO3;④ NH3.H2O;⑤ HCl
(1)上述五种溶液中既能跟盐酸反应又能跟NaOH溶液反应的是 (填序号)。
(2)上述②的水溶液呈碱性的原因是(用离子方程式表示) 。
(3)③跟足量的NaOH浓溶液在加热条件下反应的离子方程式是
.
(4)加热④,溶液中的c(OH-)的变化有甲乙两种猜想,请设计实验探究证明
甲:c(OH-)将增大。升高温度有利于电离平衡移动,使氨水中c(OH-)增大。
乙:c(OH-)将减小。受热时温度升高氨气逸出,使c(OH-)减小
实验设计:
.
(5)取10mL溶液加水稀释到500mL,则该溶液中由水电离出的c(H+)=
mol/L.

29.请选择“增大”、“减小”、“不变”、“大于”、“小于”或“等于”填空:
(1)升高温度时,水的pH将
。
(2)用水稀释0.1mol/L氨水时,c(OH-)/c(NH3•H2O)的比值将
。
(3)pH相同的盐酸和醋酸,分别用蒸馏水将其稀释到原来的m倍和n倍,稀释后两溶液的pH仍相同,则m
n。
(4)将标准状况下的2.24L
CO2通入150mL
1mol/L NaOH溶液中,则
c(HCO3-) c(CO32-)。
28.温室下取0.2mol/L的盐酸与0.2mol/LMOH等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,试回答下列问题
(1)混合溶液中由水电离出的c(H+)_______0.2mol/L盐酸中水电离出的c(H+)(填“<”、“>”、“=”)。
(2)求出混合溶液中下列算式的精确计算结果(填具体数字) (忽略混合后溶液体积的变化),
c(Cl-)-c(M+)=_____________mol/L,c(H+)-c(MOH)=_______________ mol/L
(3)室温下如果取0.2mol/LMOH溶液与0.1mol/L盐酸等体积混合,测得混合溶液的pH<7,则说明MOH的电离程度________MCl的水解程度(填“<”、“>”、“=”),溶液中各离子浓度由大到小的顺序为______________________________。
27.常温下,某水溶液M中存在的离子有:Na+、A一、H+、OH一。根据题意回答下列问题:
(1)若溶液M由0.1mo1/L的HA溶液与0.1mol/L的NaOH溶液等体积混合而得,则溶液M的pH不可能 7(填“大于”、“小于”或“等于”).
(2)若溶液M的pH>7,则c(Na+) c(A一)(填“>”、“<”或“=”).
(3)常温下,若溶液M由pH=3的HA溶液V1 mL与pH=11的NaOH溶液V2mL混合反应而得,则下列说法中正确的是 (填字母).
A.若溶液M呈中性,则溶液M中c(H+)+c(OH一)=2×10-7mol/L
B.若V1=V2,则溶液M的pH一定等于7
 C.若溶液M呈酸性,则V1一定大于V2
C.若溶液M呈酸性,则V1一定大于V2
D.若溶液M呈碱性,则V1一定小于V2
13.下列各离子浓度的大小比较,正确的是( )
A.同浓度的下列溶液中:①(NH4)2Fe(SO4)2②(NH4)2CO3③(NH4)2SO4,c(NH+4)由大到小的顺序是:①>③>②
B.常温时,将等体积的盐酸和氨水混合后,pH=7,则c(NH+4)>c(Cl-)
C.0.2mol/L Na2CO3溶液中:c(OH-)=c(HCO3-)+c(H+)+c(H2CO3)
D.0.1mol/L的NH4Cl溶液与0.05mol/L NaOH溶液等体积混合显碱性:
c(Cl-)>c(Na+)>c(NH+4)>c(OH-)>c(H+)
选择题答题表:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com