
题目列表(包括答案和解析)
4.赤铜矿的主要成分是Cu2O,辉铜矿的主要成分是Cu2S,将赤铜矿与辉铜矿混合加热有如下反应:Cu2S+2Cu2O
 6Cu+SO2↑ 下列关于该反应的说法正确的是(..................................... )
6Cu+SO2↑ 下列关于该反应的说法正确的是(..................................... )
A.Cu2S在反应中既是氧化剂,又是还原剂 B.Cu既是氧化产物,又是还原产物
C.该反应中氧化剂只有Cu2O
D.每生成19.2g Cu,反应中转移0.6mol电子
3.一定条件下,碘单质与砹单质以等物质的量进行反应可得AtI。它与Zn、NH3都能发生反应,化学方程式分别如下:2AtI+2Zn=ZnI2+ZnAt2 AtI+2NH3(l)=NH4I+NH2At
下列关于AtI性质的叙述正确的是( )
A.ZnI2既是氧化产物,又是还原产物
B.ZnAt2既是氧化产物,又是还原产物
C.AtI与液氨反应,AtI既是氧化剂,又是还原剂
D.AtI与液氨反应,是自身氧化还原反应
2.高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,是比Cl2、O3、ClO2、KMnO4氧化性更强,无二次污染的绿色水处理剂。工业上是先制得高铁酸钠,然后在低温下,在高铁酸钠溶液中加入KOH至饱和就可析出高铁酸钾(K2FeO4)。
湿法制备的主要反应方程为:2Fe(OH)3+3ClO―+4OH―=2FeO42-+3Cl―+5H2O
干法制备的主要反应方程为:2FeSO4+4Na2O2=2Na2FeO4 +2Na2SO4
下列有关说法不正确的是( )
A.高铁酸钾中铁显+3价
B.湿法中每生成1mol Na2FeO4转移3 mol电子
C.干法中每生成1mol Na2FeO4转移4 mol电子
D.K2FeO4处理水时,不仅能消毒杀菌,还能吸附水中的悬浮杂质
1.、黑火药是我国古代四大发明之一,其爆炸时发生反应的化学方程式为:S+2KNO3+3C=K2S+N2↑+3CO2↑。设该反应中转移的电子数为a mol,被2 molKNO3氧化而成的氧化产物为b mol,则a、b的值分别为( )
A.12 2.5 B.24 2.5 C.12 3.0 D.24 3.0
8. 某种优质燃油由甲、乙两种有机物混合而成,甲、乙两种物质含有C、H、O三种元素中的两种或三种。已知甲、乙及CO、H2的燃烧热如下:
某种优质燃油由甲、乙两种有机物混合而成,甲、乙两种物质含有C、H、O三种元素中的两种或三种。已知甲、乙及CO、H2的燃烧热如下:


 物质
甲 乙
CO
H2
物质
甲 乙
CO
H2
燃烧热/ kJ·mol-1 1366 5518 283 286
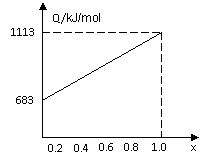 取甲、乙按不同比例混合的燃油23g,在足量的O2中燃烧时,放出的热量Q与混合物中乙的物质的量分数x的关系如图所示。试求:
取甲、乙按不同比例混合的燃油23g,在足量的O2中燃烧时,放出的热量Q与混合物中乙的物质的量分数x的关系如图所示。试求:
(1)乙的相对分子质量Mr(乙)=________。
(2)160g由甲、乙以等物质的量混合而成的燃油在347.2L O2中恰好完全燃烧,得492.8L气体,冷却到室温时,还剩余224L(气体体积均在标准状况下测定)。由此可求得混合物中C、H、O的原子个数比为_________。甲、乙的分子式为:甲_______;乙_____。
(3)1mol由甲、乙以等物质的量混合而成的燃油在一定量的O2中燃烧,放出热量2876 kJ·mol-1,则反应中生成CO___________mol。
7.已知C(石墨)、H2和CO的燃烧热分别为393.5 kJ·mol-1、285.5 kJ·mol-1l、282.8 kJ/mol。现有H2和CO组成的混合气体56.0L(标准状况),经充分燃烧后,放出总热量为710.0 kJ,并生成液态水。下列热化学方程式或描述正确的是( )
A.2CO(g)+O2(g)=2CO2(g);△H=+282.8 kJ·mol-1
B.2H2(g)+O2(g)=2H2O(g);△H=-571.6 kJ·mol-1
C.C(石墨,s)+1/2O2(g)=CO(g);△H=-110.7 kJ·mol-1
D.燃烧前混合气体中H2的体积分数为40%
6.在101kPa时,1mol物质完全燃烧生成稳定的氧化物时所放出的热量,叫该物质的燃烧热。一些烷烃的燃烧热如下表,则下列表述正确的是(............................................................................... )
 燃烧热
燃烧热
燃烧热
燃烧热
烷烃 烷烃
 /(kJ·mol-1)
/(kJ·mol-1)
/(kJ·mol-1)
/(kJ·mol-1)
甲烷 890.1 正丁烷 2878.0
乙烷 1560.8 异丁烷 2869.6
 丙烷
2221.5
2-甲基丁烷 3531.3
丙烷
2221.5
2-甲基丁烷 3531.3
A.正戊烷的燃烧热约为3540 kJ·mol-1 B.热稳定性:正丁烷<异丁烷
C.乙烷燃烧的热化学方程式为2C2H6(g)+7O2(g)=4CO2(g)+6H2O(g);△H=-1560.8kJ/mol
D.相同质量的烷烃,碳的质量分数越大,燃烧放出的热量越多
5.工业生产硫酸过程中,SO2在接触室中被催化氧化为SO3,已知该反应为放热反应。现将2mol SO2、1mol O2充入一密闭容器充分反应后,放出热量98.3kJ,此时测得SO2的转化率为50%。下列热化学方程式正确的是( )
A.2SO2(g)+O2(g) 2SO3(g);△H=-196.6 kJ·mol-1
2SO3(g);△H=-196.6 kJ·mol-1
B.2SO2(g)+O2(g) 2SO3(g);△H=-98.3 kJ·mol-1
2SO3(g);△H=-98.3 kJ·mol-1
C.SO2(g)+1/2O2(g) SO3(g);△H=+98.3 kJ·mol-1
SO3(g);△H=+98.3 kJ·mol-1
D.SO2(g)+1/2O2(g) SO3(g);△H=+196.6 kJ·mol-1
SO3(g);△H=+196.6 kJ·mol-1
4.已知:(1)H2O(g)=H2O(l);△H1=-Q1 kJ·mol-1
(2)C2H5OH(g)=C2H5OH(l);△H2=-Q2 kJ·mol-1
(3)C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g);△H3=-Q3 kJ·mol-1
其中Q1 、Q2 、Q3均大于0。若使46g液态酒精完全燃烧,最后恢复到室温,则放出的热量为( )
A.Q1 +Q2 +Q3 B.2Q1 +Q2 +Q3 C.3Q1 +Q2 +Q3 D.3Q1 -Q2 +Q3
3.下列依据热化学方程式得出的结论正确的是( )
A.已知2H2(g)+O2(g)=2H2O(g);△H=-483.6 kJ·mol-1,则氢气的燃烧热为241.8 kJ·mol-1
B.已知C(石墨,s)= C(金刚石,s);△H>0,则金刚石比石墨稳定
C.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l); =-57.4 kJ·mol-1,则含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量
D.已知2C(s)+2O2(g)=2CO2(g);△H1 2C(s)+ O2(g)=2CO (g);△H2 则△H1>△H2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com