
题目列表(包括答案和解析)
2.一种新型的燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极通入乙烷和氧气,其总反应为:2C2H6+7O2+8KOH=4K2CO3+10H2O。有关该电池的态度正确的是( )
 A.负极反应为14H2O+7O2+28e-=28OH-
A.负极反应为14H2O+7O2+28e-=28OH-
B.放电一段时间后,负极周围的pH升高
C.每消耗1mol C2H6,电路上转移的电子为14mol
D.放电过程中,电池中KOH的物质的量逐渐减少
1.常用的锌锰干电池在放电时总反应可表示为:Zn(s)+2MnO2(s)+2NH4+=Zn2++Mn2O3+2NH3+H2O放电时负极区发生的物质或微粒是( )
A.MnO2 B.MnO2和NH4+ C.Zn D.Zn2+和NH3
12.Cu、Cu2O和CuO组成的混合物,加入100mL 0.6 mol·L-1 HNO3溶液恰好使混合物溶解,同时收集到224mL NO气体(标准状况)。
(1)Cu2O跟稀硝酸反应的化学方程式为___________________。
(2)产物中硝酸铜的物质的量为_______mol。
(3)如混合物中含有0.01 mol Cu,则其中Cu2O、CuO的物质的量分别为__________mol。
(4)如混合物中Cu的物质的量为x,则其中Cu2O、CuO的物质的量及x的取值范围为_______、_______、_________。
11.六价铬的化合物有剧毒,所以要对Cr(VI)( 罗马数字表示元素的化合价,下同)废水进行化学处理。最常见的是铁氧磁体法,即把FeSO4·7H2O加入含Cr(VI)的废水中,在pH<4时,Fe2+ 还原Cr(III),调节溶液PH达8-10,使溶液中的Fe(II)、Fe(III)、Cr(III)析出组成相当于FeII[FexIII ·Cr2-xIII]O4(磁性材料铁氧体的组成)沉淀。试回答:
(1)若废水中六价铬以Cr2O72-存在。试写出在酸性条件下硫酸亚铁还原Cr2O72-的离子方程式并配平___________。
(2)由(1)的结果可确定铁氧磁体中x=________。
(3)据(2)的结果,若废水中Cr(VI)按CrO3计,则加入的FeSO4·7H2O与CrO3的质量比为_______才能除去废水中的Cr(VI)。
10.某校化学研究小组的同学在学习了金属的知识以后,对铜的化合物的性质运用对比的思想提出了如下问题。请你协助该小组的同学完成下列研究。
[提出问题]
①Cu的金属活泼性小于Al,Al(OH)3具有两性,Cu(OH)2也具有两性吗?
②通常情况下,+2价的Fe的稳定性小于+3价的Fe,+1价的Cu的稳定性也小于+2价的Cu吗?
③CuO能被H2、CO等还原,也能被NH3还原吗?
[实验方案]
(1)解决问题①需要用到的药品有CuSO4溶液、________(填试剂名称),同时进行相关实验。
(2)解决问题②的实验步骤和现象如下:取98 gCu(OH)2固体,加热至80℃-100℃时,得到黑色固体粉末,继续加热到1000℃以上,黑色粉末全部变成红色粉末A。冷却后称量,A的质量为72g。向A中加入适量的稀硫酸,得到蓝色溶液,同时观察到容器中还有红色固体存在。据此可推得,A的化学式为____________。
(3)为解决问题③,设计的实验装置如图所示(夹持及尾气处理装置未画出)
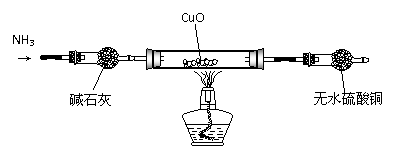

实验中观察到CuO变为红色物质,无水CuSO4变蓝色,同时生成一种无污染的气体。
[实验结论]
(1)Cu(OH)2具有两性。证明Cu(OH)2具有两性的实验现象是______________。
(2)根据“实验方案(2)”,得出+1价Cu和+2价Cu稳定性大小的结论是___________。
(3)CuO能被NH3还原。该反应的化学方程式_______________。
[问题讨论]
有同学认为NH3与CuO反应中生成的红色物质是Cu,也有同学认为NH3与CuO反应中生成的红色物质是Cu和A的混合物。请你设计一个简单的实验验证NH3与CuO反应中生成的红色物质是否含有A。
9.某校化学实验兴趣小组在“探究卤素单质的氧化性”的系列实验中发现:在足量的稀氯化亚铁溶液中,加入1-2滴溴水,振荡后溶液呈黄色。
(1)提出问题:Fe3+和Br2的氧化性谁的更强?
(2)猜想:①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生化学反应所致,则溶液呈黄色是含_____(填化学式,下同)所致。
 ②乙同学认为氧化性:Br2>Fe3+,故上述实验现象是发生化学反应所致,则溶液呈黄色是含_________所致。
②乙同学认为氧化性:Br2>Fe3+,故上述实验现象是发生化学反应所致,则溶液呈黄色是含_________所致。
(3)设计实验变验证:
丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案,并通过观察实验现象,证明了乙同学的观点是正确的。
供选用的试剂:a、酚酞试液;b、CCL4;C、无水酒精;d、KSCN溶液
请你在下表中写出丙同学选用的试剂及实验中观察到的现象(试剂填序号)。

 选用试剂
实验现象
选用试剂
实验现象
方案一
方案二
 (4)结论:氧化性:Br2>Fe3+。故在足量的稀硫酸亚铁溶液中,加入1-2滴溴水,溶液呈黄色所发生的离子方程式为______________________________________________。
(4)结论:氧化性:Br2>Fe3+。故在足量的稀硫酸亚铁溶液中,加入1-2滴溴水,溶液呈黄色所发生的离子方程式为______________________________________________。
(5)实验后的思考:①根据上述实验推测,若溴化亚铁溶液中通入氯气,首先被氧化的离子______(填离子的化学式)。
②在100 mL FeBr2溶液中通入2.24L Cl2(标准状况),溶液中有1/2的Br-被氧化成单质,则原FeBr2溶液中FeBr2的物质的量浓度为____________________。
8.用0.2 mol/L Na2SO4溶液32 mL还原含2×10-3 mol X2O72-的溶液,过量的Na2SO4用0.1 mol/L KMnO4酸性溶液氧化(其中KMnO4被还原成Mn2+),共消耗KMnO4溶液1.6mL,则元素X在还原产物中的化合价为( )
A.+1 B.+2 C.+3 D.+4
7.羟胺(NH2OH)是一种还原剂,现用25.00mL 0.049mol/L 羟胺的酸性溶液跟足量的Fe2(SO4)3溶液在煮沸条件下反应,生成的Fe2+恰好与24.50 mL 0.020 mol/L的酸性KMnO4溶液完全反应生成Fe2(SO4)3、MnSO4等物质,则上述反应中羟胺的氧化产物是( )
A.N2 B.N2O C.NO D.NO2
6.已知某金属硝酸盐受热分解时生成了金属氧化物、二氧化氮和氧气。测得产物中NO2与O2的体积比为6∶1(同温同压下测得),该硝酸盐分解时金属化合价的变化情况是 ( )
A.升高 B.降低 C.不变 D.不能确定
5.水热法制备Fe3O4纳米颗粒的总反应为:3Fe2++2S2O32-+O2+xOH―=Fe3O4+ S4O62-+2H2O 下列说法正确的是( )
A.硫元素被氧化,铁元素被还原 B.Fe2+、S2O32-都是还原剂
C.x=2 D.每生成1 mol Fe3O4,转移3 mol电子
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com