
题目列表(包括答案和解析)
(1)解决此问题需要用到的药品有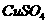 溶液、 、
(填写序号)
溶液、 、
(填写序号)
A. 溶液 B.
溶液 B. 溶液 C.
溶液 C. 溶液 D.稀
溶液 D.稀 溶液
溶液
(2)假设Cu(OH)2具有两性,应该看到的实验现象是 .
4. 已知CuSO4溶液分别与Na2CO3溶液和Na2S溶液的反应情况如下:
已知CuSO4溶液分别与Na2CO3溶液和Na2S溶液的反应情况如下:
(1)CuSO4+Na2CO3。
主要:Cu2++CO32-+H2O=Cu(OH)2↓+CO2↑
次要:Cu2++CO32-=CuCO3↓
(2)CuSO4+Na2S。
主要:Cu2++S2-=CuS↓
次要:Cu2++S2-+2H2O=Cu(OH)2↓+H2S↑
在下列几种物质的溶解度大小的比较中,正确的是( )
A.CuS<Cu(OH)2<CuCO3 B.CuS>Cu(OH)2>CuCO3
C.Cu(OH)2>CuCO3>CuS D.Cu(OH)2<CuCO3<CuS
3.要除去NaCl溶液混有的少量Na2S,在下列试剂中,最理想的是( )
A.CuCl2 B.AgCl C.NaOH D.Ag2S
2.实验①:向盛有0.1mol·L-1 AgNO3溶液的试管中滴加0.1 mOL·L-1 NaCl溶液至不再有白色沉淀生成为止。取上层澄清溶液,逐滴加入饱和Na2S溶液。
实验②:向盛有0.1mol·L-1 AgNO3溶液的试管中滴加饱和Na2S溶液至沉淀完全,取上层澄清溶液,逐滴滴加0.1mol·L-1 NaCl溶液。
对上述实验结果的现象描述正确的是( )
A.实验①有黑色沉淀,实验②有白色沉淀
B.实验①有黑色沉淀,实验②无沉淀
C.实验①无沉淀,实验②有白色沉淀
D.实验①和实验②都无沉淀
1.相同温度下,将足量的AgCl分别放入下列溶液中,AgCl的溶解度大小顺序为( )。
①20 mL0.1mol·L-1(NH4)2CO3溶液②40mL0.02mol·L-1BaCl2溶液③40mL0.03 mol·L-1盐酸④10mL蒸馏水⑤50mL0.05mol·L-1 AgNO3溶液
A.①=②=③=④=⑤ B.①>④>③>②>⑤
C.⑤>④>①>②>③ D.④>③>⑤>①>②
15. 某化学研究性学习小组在研讨Fe3+和SO32-之间发生的反应时形成了两种观点。一是发生氧化还原反应:2Fe3++SO32-+H2O=2Fe2++SO42-+2H+;二是发生水解反应:2Fe3++3SO32-+3H2O=2Fe(OH)3↓+3SO2↑。为了验证这两种观点的正确性,同学们设计并实施了下列实验,请你参与并协助完成相关学习任务。
某化学研究性学习小组在研讨Fe3+和SO32-之间发生的反应时形成了两种观点。一是发生氧化还原反应:2Fe3++SO32-+H2O=2Fe2++SO42-+2H+;二是发生水解反应:2Fe3++3SO32-+3H2O=2Fe(OH)3↓+3SO2↑。为了验证这两种观点的正确性,同学们设计并实施了下列实验,请你参与并协助完成相关学习任务。
[实验探究]
(1)先向试管中注入3mL Na2SO3浓溶液,然后加入少量BaCl2溶液,有白色沉淀生成,再加入少量稀盐酸,生成的沉淀完全溶解并有无色气体产生。这一实验目的是__________。
(2)向试管中加入3mL FeCl3浓溶液,逐滴加入Na2SO3浓溶液,观察到溶液颜色由黄色变为红棕色,继续加入Na2SO3浓溶液,溶液颜色加深,最终变为红褐色(整个过程中无气体或沉淀产生)。向该红褐色液体中逐滴加入稀盐酸至过量,可以观察到的现象是____________________;此时,再向试管中加入BaCl2溶液,有少量白色沉淀生成,产生该白色沉淀的离子方程式_________________。
(3)将FeCl3浓溶液和Na2SO3浓溶液稀释后重复实验(2)的操作。实验现象基本相同。由上述实验可以得出的结论是_____________________。
[问题讨论]
(4)如果在FeCl3浓溶液中加入Na2CO3浓溶液,能观察到生成红褐色沉淀和无色气体的现象,该反应的离子方程式是__________________。
(5)Na2SO3和Na2CO3分别与氯化铁溶液反应的现象不同,可能的原因是____________。
14.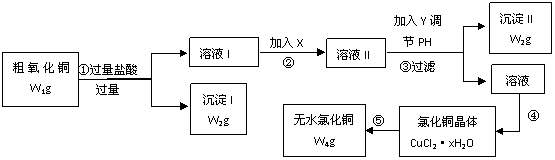 某化学研究性学习小组拟采用粗氧化铜(含少量氧化亚铁及不溶于酸的杂质)制取无水氯化铜并测定样品中氧化铜的质量分数,其实验流程如图所示:
某化学研究性学习小组拟采用粗氧化铜(含少量氧化亚铁及不溶于酸的杂质)制取无水氯化铜并测定样品中氧化铜的质量分数,其实验流程如图所示:

 实验过程中的pH调节为:
实验过程中的pH调节为:
物质 开始沉淀时的pH 完全测定时的pH

Fe(OH)3 2.7 3.7
Fe(OH)2 7.6 9.6
Cu(OH)2 5.2 6.4
请回答以下问题:
(1)步骤①、③过滤操作中,除用到仪器:铁架台(带铁圈)、漏斗、烧杯除外,还需要使用的仪器用品有_________。
(2)步骤①中发生的离子反应方程式为_______________。(3)步骤②溶液Ⅰ中加入试剂X是_______(填下列试剂的编号),其目的是_______。
a、氢氧化钠 b、氯水 c、碱式碳酸铜 d、氧化铜
(4)步骤③中将溶液pH调节到的范围是___________[选填问题(3)所给试剂的编号],选择这种试剂的原因是________。
(5)步骤⑤要得到无水氯化铜,需要在干燥的HCl气流中加热CuCl2·xH2O,其原因是_______________。
(6)经检测,CuCl2·xH2O中含水28.6%,则CuCl2·xH2O中x的值为________。
(7)若步骤④中80%的氯化铜转入晶体,其余各步转化都是完全的,请根据流程图中表示的质量数据,写出样品中氧化铜质量分数的计算式。
13.若甲的化学式为RCl3,其溶液在加热蒸干并灼烧时可发生反映:a、甲+H2O 乙+丙b、乙
乙+丙b、乙 氧化物+H2O
氧化物+H2O
 (1)若甲为某用途广泛的金属元素的氯化物,其溶液在上述变化生成的氧化物为红棕色粉末,则该金属在周期表中的位置是_________。
(1)若甲为某用途广泛的金属元素的氯化物,其溶液在上述变化生成的氧化物为红棕色粉末,则该金属在周期表中的位置是_________。
(2)若甲为某短周期金属元素的氧化物,则甲发生a反应的化学方程式为________________。
(3)将以上两种金属单质用导线连接,插入一个盛有NaOH溶液的烧杯中构成原电池,则反击发生的电极反应为___________。
11.将标准状况下的2.24L CO2通入150mL 1mol·L-1NaOH溶液中,下列表达式正确的是( )
A.c(HCO3-)>c(CO32-) B.c(OH-)=2c(CO32-)+c(HCO3-)
C.c(OH-)=c(HCO3-)+c(H+)+c(H2CO3)
D.c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-)
12已知:(1)H2SO4在水溶液中的电离方程式为:H2SO4=H++HSO4-,HSO4- H++SO42-;(2)NaHSO4溶液呈酸性。则下列有关说法正确的是( )
H++SO42-;(2)NaHSO4溶液呈酸性。则下列有关说法正确的是( )
A.Na2SO4溶液呈酸性
B.HSO4-在水溶液中既能发生电离,又能发生水解
C.相同浓度的系H2SO4和NaHSO4溶液中的SO42-的浓度是后者大
D.NaHSO4溶液中:c(H+)=c(SO42-)+c(OH-)
10.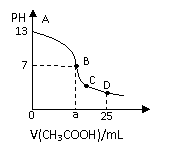 25℃时,在25mL0.1mol·L-1的NaOH溶液中逐滴加入0.2mol·L-1的CH3COOH溶液,溶液pH的变化曲线如图所示。下列分析的结论正确的是( )。
25℃时,在25mL0.1mol·L-1的NaOH溶液中逐滴加入0.2mol·L-1的CH3COOH溶液,溶液pH的变化曲线如图所示。下列分析的结论正确的是( )。
A.B点的横坐标a=12.5,且有c(Na+)=C(CH3COO-)
B.C点时C(CH3COO-)>c(Na+)>CCH+)>c(OH-)
C.D点时C(CH3COO-)+C(CH3COOH)=2c(Na+)
D.对曲线上上A、B间任一点,溶液都有:c(Na+)> C(CH3COO-)>c(OH-)>c(H+)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com