
题目列表(包括答案和解析)
7.某溶液中大量存在五种离子:NO3-、SO42-、Fe3+、H+、X,其物质的量之比为:
n(NO3-):n(SO42-):n(Fe3+):n(H+) :n (X) = 2:3:1:3:1,则X可能为
A.Fe2+ B.Mg2+ C.Cl- D.Ba2+
6.设NA为阿伏加德罗常数,下列说法不正确的是
A.用含0.01molFeCl3的饱和溶液制成的Fe(OH)3胶体中所含胶粒数小于0.01NA
B.标准状况下,22.4 L Cl2和HCl的混合气体中含分子数为NA
C.30 g甲醛中含有的共用电子对数为4NA
D.0.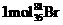 原子中含中子数为3.6NA
原子中含中子数为3.6NA
5.保护环境,人人有责。下列说法错误的是
A.倡导人们在购物时使用纸袋或布袋、最好不用塑料袋,是为了防止白色污染
B.对废电池集中处理是为防止电池中汞、镉、铅等重金属离子对土壤和水源的污染
C.北京地区空气污染指数的主要项目是:SO2、NO2、CO2及可吸入颗粒物
D.白口铁(镀锌铁)和马口铁(镀锡铁)比较,镀层被破坏后,马口铁更易被腐蚀
28.(8分)(1)Cl2+2I-=2Cl-+I2
(2)3HClO3 = HClO4 + 2O2 + Cl2 + H2O
(3)10 67.2
北京市石景山区2007年高三理科综合统一测试能力试卷(化学部分)
27.(18分) (1)有无色气泡产生 (2分) 强 (1分)
(2)高锰酸钾溶液紫色褪去 (2分) 还原(2分)
(3)酯化(取代)(1分)吸收乙醇,除去乙酸,降低乙酸乙酯溶解度,并有利于分层
(3分)(答出其中一点且叙述合理得1分) 防止倒吸(或防止B中液体倒吸至A中)(1分)
(4)a、b、c(3分)
(5)产生的CO有毒,未经处理、吸收,会污染空气(2分)(其他合理答案均给分)
26.(14分)
(1)CH3OH (2分), 羟基 (1分),取代反应(1分)
(2)(6分,2分/个)
③→④
③→⑥
⑧→⑦
(3)HCOOCH3(2分), HOCH2CHO(2分)
25.(20分)(1)如图。(2分)
(2)A.NaOH > Mg(OH)2 (2分)
B.HF > HCl (2分)
C.N2 (2分)
D.b;d (4分)
(3)Al2O3 + 2OH- = 2AlO2- + H2O (2分)
H2(g) + 1/2 O2(g) = H2O(l) ;△H = -2akJ/mol (2分)
正极(2分), H2 – 2e- + 2OH-= 2H2O (2分)
27.(18分)已知:
|
名称 |
化学式 |
颜色、状态 |
溶解性(g) |
熔点(℃) |
密度(g/cm3) |
|
乙二酸 |
H2C2O4 |
- |
8.6(20℃) |
189.5 |
1.900 |
|
二水合乙二酸 |
H2C2O4·2H2O |
无色晶体 |
- |
101.5 |
1.650 |
注:乙二酸( HOOC-COOH)俗称草酸,带2个结晶水的乙二酸俗称草酸晶体,草酸晶体失去结晶水得无水草酸,在约157℃时升华,其盐草酸钙和草酸氢钙均为白色不溶物。
根据上述信息,回答下列问题。
(1)向盛有Na2CO3粉末的试管里加入约3mL乙二酸溶液,观察到的现象是 ,说明乙二酸的酸性比碳酸 (填“强”或“弱”)。
(2)向盛有5mL乙二酸饱和溶液的试管里滴入3滴用硫酸酸化的0.5%(质量分数)的高锰酸钾溶液,振荡,观察到的现象为 ,说明乙二酸
有 性。
(3)向A试管中加入3mL乙醇,然后边振荡试管边加入2mL浓硫酸和2mL乙二酸,按下图甲连接好装置,加热3-5min,在B管中有油状且带有香味的液体产生,该现象说明发生
了 反应(填有机反应类型)。在B试管中加入饱和Na2CO3溶液的目的是
,导管在液面上的原因是 。
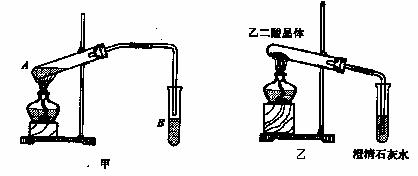
(4)已知草酸分解的化学方程式为: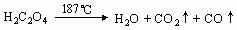 ,
,
用图乙装置加热草酸晶体,验证草酸受热分解及其产物,但有人认为该装置不合理。请你根据草酸晶体的某些物理常数和实验目的,分析不合理原因 (从下列序号中选择)。
a.草酸晶体的熔点低,未分解之前就已融化并流到试管口,不利于化学反应的进行及实验现象的观察
b.因为加热的是草酸晶体,所以该装置最多只能检验一种分解产物,不能检验是否还有其他分解产物
c.在未洗气的情况下通入石灰水,还可能因草酸蒸气与石灰水反应生成草酸钙沉淀,对实验有干扰
(5)该装置也不符合绿色化学的要求,试说明原因 。
|
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
|
D |
B |
A |
C |
C |
B |
B |
A |
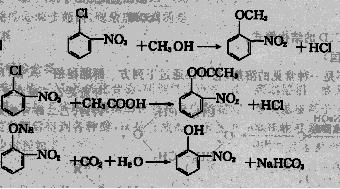
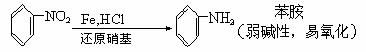
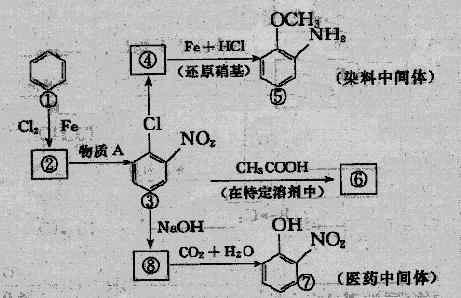
26.(14分)下图中①-⑧都是含有苯环的化合物,在化合物③中,由于氯原子在硝基的邻位上,因而反应的活性增强,容易和反应试剂中跟氧原子相连的氢原子相结合,从而生成HCl。
已知:
根据题给信息,回答下列问题:
(1)请写出与③作用生成④的有机物的结构简式 ,它所含官能团的名称 ,写出①转化成②所发生反应的反应类型 。
(2)请写出图中由化合物③变成化合物④,由化合物③变成化合物⑥,由化合物⑧变成化合物⑦的化学方程式(不必注明反应条件,但是要配平)。
③→④ 。
③→⑥ 。
⑧→⑦ 。
(3)根据下列要求写出乙酸的同分异构体的结构简式:
A. 能发生银镜反应的酯类物质 ;
B. 能发生银镜反应,且能和金属钠作用生成氢气的物质 。
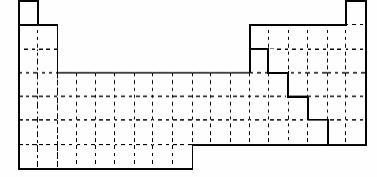
25.(20分)下图是元素周期表的框架
|
① |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
② |
③ |
④ |
|
|
⑤ |
⑥ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
⑦ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(1)请在上面元素周期表中画出金属元素与非金属元素的分界线。
(2)依据元素周期表回答下列问题:
A.周期表中的元素⑤和元素⑥的最高价氧化物的水化物碱性强弱顺序是
(用化学式表示)。
B.周期表中的元素④和元素⑦的氢化物的熔、沸点高低顺序是
(用化学式表示)。
C.①-⑦元素的单质,在常温下化学性质稳定,通常可用作保护气的是 (填写分子式)。
D.在上面元素周期表中全部是金属元素的主族是 ;全部是非金属元素的主族是 (填写字母a、b、c、d)。
a.ⅠA族 b. ⅡA族 c. ⅥA 族 d.ⅦA族
(3)已知甲元素位于第三周期,且其原子半径为同周期金属元素中原子半径最小的,请写出甲的氧化物与NaOH溶液反应的离子方程式 ; 在一定条件下1g ①的单质在足量③的单质中完全燃烧生成液态物质时,放出的热量为a kJ;
 请写出此条件下表示①的单质燃烧热的热化学方程式
;
请写出此条件下表示①的单质燃烧热的热化学方程式
;
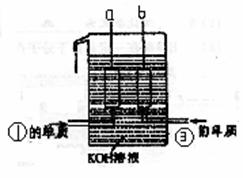
①、③两种元素的单质已被应用于字宙飞船的
燃料电池中,如右图所示,两个电极均由多孔
性碳构成,通入的两种单质由孔隙逸出并在电
极表面放电。
请回答:b是电池的 极;
a电极上的电极反应式是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com