
题目列表(包括答案和解析)
3.下列说法中正确的是
A.任何化学反应都伴随着能量的变化 B.有氧气参加的反应都是放热反应
C.H2在O2中燃烧,化学能全部转化为热能 D.有能量变化的过程一定是化学变化
2.在化学反应中,发生能量变化的根本原因是
A.物质组成发生变化 B.化学键的断裂与形成
C.物质总质量发生变化 D.元素种类发生变化
1.下列叙述中正确的是
A.离子化合物中不一定有金属元素
B.离子晶体中不可能存在非极性共价键
C.原子晶体中不可能存在极性共价键
D.共价化合物中各原子都形成8电子稳定结构
29.(5分) 媒体报道:“洁厕灵(含无机酸)和84消毒液(主要成分为次氯酸钠和氯化钠)混和使用会使人中毒”。为验证此报道,某实验小组学生利用如图装置(夹持装置略去)进行实验,请回答下列问题:
①该小组学生测定84消毒液呈碱性,其原因(写离子方程式)
 ②当关闭K 处止水夹,从分液漏斗滴入洁厕灵,观察到烧瓶中有黄绿色气体生成,该反应的离子方程式
。
②当关闭K 处止水夹,从分液漏斗滴入洁厕灵,观察到烧瓶中有黄绿色气体生成,该反应的离子方程式
。
③为防止污染空气,实验后要把圆底烧瓶中的黄绿色气体排到B中吸收,简述实验操作(可以添加用品)
。
28.(6分)有一无色透明溶液,欲确定是否含有下列离子:K+、Mg2+、Al3+、Fe2+、Ba2+、NO3-、SO42-、Cl-、I-、HCO3- ,取该溶液实验如下:
|
实验步骤 |
实验现象 |
|
(1)取少量该溶液,加几滴甲基橙 |
溶液变红色 |
|
(2)取少量该溶液加热浓缩,加Cu片和浓 H2SO4
,加热 |
有无色气体产生,气体遇空气变成红棕色 |
|
(3)取少量该溶液,加BaCl2溶液 |
有白色沉淀生成 |
|
(4)取(3)中上层清液,加AgNO3溶液 |
有稳定的白色沉淀生成,且不溶于HNO3 |
|
(5)取少量该溶液,加NaOH溶液 |
有白色沉淀生成,当NaOH过量时沉淀部分溶解 |
由此判断:
(1)溶液中肯定不存在的离子有 ,
溶液中肯定存在的离子是 。
(2)为进一步确定可能存在的离子,请设计实验进行验证(写明操作、现象、结论)
27.(14分)下图是元素周期表的框架,请参照①--⑧在周期表中的位置,用化学用语回答下列问题:
|
① |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
② |
③ |
④ |
|
|
|
⑤ |
|
|
|
|
|
|
|
|
|
|
|
⑥ |
⑦ |
|
|
⑧ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(1)请在上面元素周期表中画出金属元素与非金属元素的分界线
(2)④⑤⑥的原子半径由大到小的顺序为(填元素符号)_________________________。
(3)②③⑦的最高价含氧酸的酸性由强到弱的顺序是(填化学式)___________________。
(4)34号元素位于周期表中第 周期,第 族,最高价氧化物对应水化物的化学式为
(5)第三周期原子半径最小的金属元素的单质与NaOH溶液反应的化学方程式为
。
(6)①④⑤三种元素形成既含离子键又含极性共价键的化合物电子式为_____________;
①---⑧元素中,某两种元素的原子按1:1组成一种常见液态化合物,其稀溶液易被催化分解,该液态化合物的电子式是 。可选择下列物质中的______作催化剂(填序号)。
a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4
(7)由表中①--⑧元素形成的常见物质X、Y、Z、M、N可发生以下反应:

①X溶液与过量的Y溶液反应的离子方程式为 ,
②M可能是 (填一种常见物质的化学式)
③常温下,为使0.1 mol·L-1 M 溶液中由M电离的阴、阳离子浓度相等,应向溶液中加入一定量的Y溶液至PH________7( 填 > = < )。
26.(5分)某反应中反应物与生成物有:AsH3 、H2SO4 、KBrO3 、K2SO4 、H3AsO4 、H2O和一种未知物质X。
(1)已知KBrO3在反应中得到电子,则该反应被还原的元素是 还原剂是 。
(2)已知0.2mol KBrO3在反应中得到 1 mol电子生成X,则X的电子式为 。
(3) 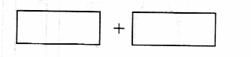 将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并标出电子转移的方向和数目:
将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并标出电子转移的方向和数目:
(4)根据上述反应可推知 。
a.氧化性:KBrO3 > H3AsO4 b.氧化性:H2SO4 > KBrO3
c.还原性:AsH3 > X d.还原性: X > AsH3
25.根据以下事实得出的判断一定正确的是
A.HA的酸性比HB的强,则HA溶液的 pH一定比HB溶液的小
B. 和
和 的电子层结构相同,则A原子的核电荷数比B原子的多
的电子层结构相同,则A原子的核电荷数比B原子的多
C.同温下 ,A盐溶解度比B盐大,则A盐溶液的物质的量浓度比B盐溶液的大
D.A原子失去的电子比B原子的多,则A单质的还原性比B单质的强
Ⅱ卷 (50分)
24.NA代表阿伏加德罗常数,下列有关叙述正确的是
A.标准状况下,2.24LH2O含有的分子数等于0.1NA
B.常温下,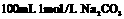 溶液中阴离子总数大于0.1NA
溶液中阴离子总数大于0.1NA
C.分子数为NA的CO、C2H4混合气体体积约为22.4L,质量为28g
D.3.4 中含N-H键数目为
中含N-H键数目为
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com