
题目列表(包括答案和解析)
13.物质氧化性、还原性的强弱,不仅与物质的结构有关,还与物质的浓度、反应温度等有关。下列各组物质:
①Cu与HNO3溶液 ②Fe与盐酸 ③Zn与H2SO4溶液 ④Cl2与FeCl2溶液
由于浓度不同而能发生不同的氧化还原反应的是
A.①②③ B.①③④ C.①③ D.①②③④
12.下列反应的离子方程式书写正确的是
A.亚硫酸钠溶液中加入硝酸:SO32-+2H+===H2O+SO2↑
B.铜片与浓硝酸反应:Cu+2NO3-+4H+===Cu2++2NO2↑+2H2O
C.硫化钠的水解:S2-+2H2O H2S+2OH-
H2S+2OH-
D.向苯酚钠溶液中通入少量CO2:2C6H5O-+CO2+H2O→2C6H5OH+CO32-
11.S(单斜)和S(正交)是硫的两种同素异形体。已知:
①S(单斜,s)+O2(g)===SO2(g);△H1=-297.16kJ·mol-1
②S(正交,s)+O2(g)===SO2(g);△H2=-296.83kJ·mol-1
③S(单斜,s)=== S(正交,s);△H3
下列说法中正确的是
A.单斜硫转化为正交硫是物理变化 B.△H3=0.33kJ·mol-1
C.S(单斜,s)=== S(正交,s);△H3<0 D.单斜硫比正交硫稳定
10. 右图是在待镀铁制品上镀铜的实验装置,则下列说法正确的是
右图是在待镀铁制品上镀铜的实验装置,则下列说法正确的是
A.电源a极为负极
B.Ⅰ极上铜放电而逐渐消耗
C.电极Ⅱ上发生的电极反应为:Fe-2e-=== Fe2+
D.Ⅱ极上Cu2+放电而使溶液中Cu2+浓度逐渐变小
9.某晶体由两种阳离子、一种阴离子和结晶水组成,取少量该晶体进行如下实验:
①晶体置于试管中加热,试管口有液体生成;
②待试管冷却后,加水使固体全部溶解;
③向试管中逐滴加入Ba(OH)2溶液至过量,同时加热,沉淀的物质的量先增多后减小,但最终仍有沉淀未溶解,在此过程中还有刺激性气味的气体生成。根据以上实验判断,该晶体是
A.KAl(SO4)2·12H2O
B.NH4Al(SO4)2·12H2O
C.(NH4)2Fe(SO4)2·6H2O
D.KCl·MgCl2·6H2O
8.石墨是层状晶体,每一层内碳原子排列成正六边形,一个个正六边形排列成平面的网状结构。将每对相邻的碳原子间的化学键看成一个化学键,则石墨晶体每一层内碳原子数与碳碳化学键键数的比例是
A.1 : 1 B.1 : 2 C.1 : 3 D.2 : 3
7.下列反应中,氧化剂与还原剂的物质的量之比为2:1的是
A.Cl2+2NaOH===NaCl+NaClO+H2O
B.2CH3COOH+Ca(ClO)2===2HClO+(CH3COO)2Ca
C.I2+2NaClO3 2NaIO3+Cl2↑
2NaIO3+Cl2↑
D.4HCl+MnO2  MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
6.以下实验装置一般用于分离互溶的液体物质的是

5.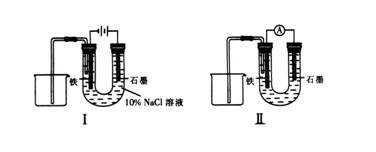 用下图Ⅰ所示装置通电10分钟后,去掉直流电源,连接成图Ⅱ所示装置,可观察到U形管左端铁电极表面析出白色胶状物质,U形管右端液面上升。下列说法正确的是
用下图Ⅰ所示装置通电10分钟后,去掉直流电源,连接成图Ⅱ所示装置,可观察到U形管左端铁电极表面析出白色胶状物质,U形管右端液面上升。下列说法正确的是
A.装置Ⅰ中石墨电极上方得到气体的体积比铁电极上方得到气体的体积大
B.用装置Ⅱ进行实验时铁电极的电极反应为:Fe-2e-+2OH- ===Fe(OH)2↓
C.用装置Ⅱ进行实验时石墨电极的电极反应为:2H++2e-===H2↑
D.装置Ⅰ通电10分钟后溶液pH降低
4.下列有关概念的判断依据的说法中正确的是
A.氧化还原反应:是否有化学键的断裂与形成
B.强电解质:水溶液或熔化状态下是否导电
C.离子反应:反应中是否有离子参加或生成
D.中和反应:反应中是否有水生成
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com