
题目列表(包括答案和解析)
3. 不具有放射性的同位素称之为稳定同位素,近20年来,稳定同位素分析法在植物生理学生态学和环境科学研究中获得广泛应用。如在陆地生态系统研究中,2H、13C、15N、18O、34S等常用做环境分析指示物。下列说法中正确的是( )
不具有放射性的同位素称之为稳定同位素,近20年来,稳定同位素分析法在植物生理学生态学和环境科学研究中获得广泛应用。如在陆地生态系统研究中,2H、13C、15N、18O、34S等常用做环境分析指示物。下列说法中正确的是( )
A.34S原子核内的中子数为16 B.13C和15N原子核内的质子数相差2
C.1H216O在相同条件下比1H218O更易蒸发 D.2H+的酸性比1H+的酸性更强
2.“酸碱质子理论”认为凡是能够给出质子(H+)的分子或离子都是酸,凡是能够接受质子的分子或离子都是碱,物质酸性(碱性)的强弱取决于分子或离子给出(接受)质子能力的大 小。按照“酸碱质子理论”,下列说法正确的是( )
A.2Na + 2H2O=2NaOH + H2↑是酸碱反应
B. ClO-+
H2O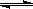 HClO
+ OH-是酸碱反应
HClO
+ OH-是酸碱反应
C.碱性强弱顺序:OH->ClO->CH3COO-
D.HCO3-既是酸又是碱,NH3既不是酸又不是碱
1.据最新报道,科学家发现了如下反应: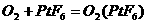 ,已知
,已知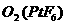 为离子化合物,其中Pt为+5价,对于此反应正确的是( )
为离子化合物,其中Pt为+5价,对于此反应正确的是( )
A.在此反应中,每生成1mol
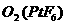 则转移1mol电子
则转移1mol电子
B.在此反应中,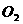 是氧化剂,
是氧化剂,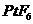 是还原剂
是还原剂
C. 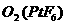 中氧元素的化合价是+1价
中氧元素的化合价是+1价
D.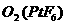 中仅存在离子键不存在共价键
中仅存在离子键不存在共价键
23.(4).取1g含SiO2和FeS2的矿石样品,在氧气中充分燃烧,残余固体质量为0.84g。用这种矿石100t,可以制得98%的H2SO4多少吨?(设生产过程中硫损失2%)
22.(9分)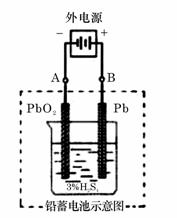
铅蓄电池是典型的可充型电池,它的正负极格板是惰性材料,电池总反应式为:
Pb+PbO2+4H++2SO2-4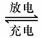 2PbSO4+2H2O
2PbSO4+2H2O
请回答下列问题(不考虑氢、氧的氧化还原):
(1) 放电时:正极的电极反应式是______________;电解液中H2SO4的浓度将变________;当外电路通过1 mol电子时,理论上负极板的质量增加________g。
(2) 在完全放电耗尽PbO2和Pb时,若按题右图连接,电解一段时间后,则在A电极上生成__________、B电极上生成________,此时铅蓄电池的正负极的极性将________________________。
21.(10分)已知:两个羟基同时连在同一碳原子上的结构是不稳定的,它将发生脱水反应:
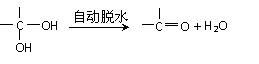
现有分子式为C9H8O2Br2的物质M,有机物C的相对分子质量为60,在一定条件下可发生下述一系列反应: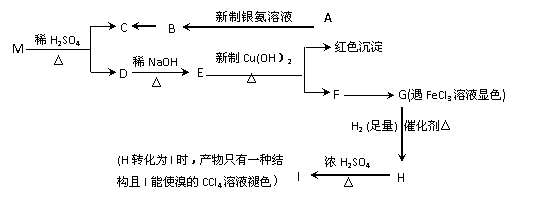
请回答下列问题:
⑴G→H的反应类型是 ______ 。
⑵C的结构简式为 __________ ;M的结构简式为 __________ 。
⑶写出下列反应的化学方程式:
①A→ B的化学方程式: _______ ;
②H→I的化学方程式: ___ 。
20、(8分)某强碱性溶液中可能含有的离子是K+、NH4+、Al 3+ 、AlO2-、SO42- 、SiO32- 、CO32-、Cl-中的某几种离子,现进行如下实验:
①取少量的溶液用硝酸酸化后,加Ba(NO3)2溶液,无沉淀生成。
②另取少量溶液加入盐酸,其现象是:一段时间保持原样后,开始产生沉淀并逐渐增多,沉淀量基本不变后产生一种气体,最后沉淀逐渐减少至消失。
(1)原溶液中肯定存在的离子是_______ ______,
肯定不存在的离子是_______ _________
(2)已知一定量的原溶液中加入5 mL 0.2 mol/L盐酸时,沉淀会完全消失,加入足量的硝酸银溶液可得到沉淀0.187 g,则原溶液中是否含有Cl-?_________________。
(3)按照反应顺序逐步书写出②中发生反应的离子反应方程式
① ②
③ ④
⑤
19.(10分)A、B、C、D、E、F均是元素周期表中按原子序数依次增大的前20号元素,其中只有A、D和B、E分别是同一主族元素,B、E两元素原子核中质子数之和是A、D两元素原子核中质子数之和的两倍,又知六种元素的单质中有三种气体、三种固体。部分元素在元素周期表中的相对位置关系如下:
|
|
C |
|
E |
|
请回答:
(1)D、E组成的常见的化合物,其水溶液呈碱性,原因是
(用离子方程式表示)。
(2)E的单质能跟D的最高价氧化物对应水化物的热浓溶液发生氧化还原反应,生成的两种正盐的水溶液均呈碱性,写出该氧化还原反应的离子方程式 。
(3)C、F所形成的化合物为离子化合物,其晶体结构模型如下:
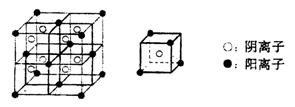
该离子化合物的化学式为 。
(4)4.0gE的单质在足量的B的单质中完全燃烧,放出37.0kJ热量,写出其热化学方程式:
。
(5)用A元素的单质与B元素的单质可以制成电池,电池中装有KOH浓溶液,用多孔的金属惰性电极浸入KOH浓溶液,两极均有特制的防止气体透过的隔膜,在A极通入A的单质,B极通入B的单质,则A极是该电池的 极;B极的电极反应式是 。
18.(7分)A、B、C三只烧杯中,依次分别盛有NaOH溶液、KSCN溶液、煮沸的蒸馏水,各滴入FeCl3溶液,试根据实验现象分别回答以下问题:⑴分别写出三只烧杯中形成分散系的名称:A , B C 。
⑵写出A中形成分散系的离子方程式 。
⑶写出C中形成分散系的化学方程式 。
17.(4分)理论预测以下物质的物理性质,用>、=、<填空:
(1)CS2的沸点_________ CO2的沸点。 (2)CsCl的熔点_________KCl的熔点。
(3)金属K的硬度_________金属Ca的硬度 4)金刚石的硬度_________晶体硅的硬度。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com