
题目列表(包括答案和解析)
4.根据主族元素的原子序数不能确定的是( )
A.质子数 B. 中子数 C. 价电子数 D. 相对原子质量
3.下列两核间距最小的离子化合物是( )
A.KCl B. NaF C. HF D. CaS
2.元素X、Y、Z的原子序数都小于18,X的阳离子,Y的阳离子和Z的阴离子都具有相同的电子层结构,Y的阳离子半径小于X的阳离子半径,则元素X、Y、Z的原子序数由小到大的顺序依次是( )
A.Z、Y、X B.Y、Z、X
C.Y、X、Z D.Z、X、Y
1.11g 2H218O所含的中子的物质的量为( )
A.4.5mol B.5mol C.5.5mol D.6mol
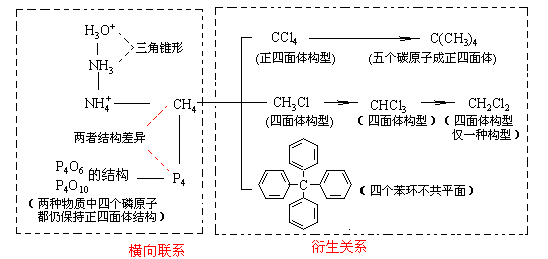
4.以典型分子结构为起点进行纵横联系
以甲烷为中心可进行如下图所示的联系:
[典型题析]
[例1] 下列指定微粒的个数比为2:1的是( )
A.Be2+离子中的质子和电子
B.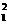 H原子中的中子和质子
H原子中的中子和质子
C.NaHCO3晶体中的阳离子和阴离子
D.BaO2(过氧化钡)固体中的阴离子和阳离子
[解析] Be2+中含有4个质子、2个电子。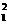 H原子中含有1个中子和1个质子。NaHCO3晶体中的钠离子跟碳酸氢根离子的个数比为1:1。BaO2(过氧化钡)固体中含有Ba2+、O22-阴离子和阳离子的个数比为1:1。所以答案选A。
H原子中含有1个中子和1个质子。NaHCO3晶体中的钠离子跟碳酸氢根离子的个数比为1:1。BaO2(过氧化钡)固体中含有Ba2+、O22-阴离子和阳离子的个数比为1:1。所以答案选A。
[例2]酸根RO3-所含电子数比硝酸根NO3-的电子数多10,则下列说法正确的是( )。
(A)R原子的电子层数比N的电子层数多1
(B)RO3-中R的化合价与NO3-中的N的化合价相等
(C)RO3-和NO3-只能被还原,不能被氧化
(D)R和N为同族元素
[解析]从“酸根RO3-所含电子数比硝酸根NO3-的电子数多10”可得出R元素的原子序数应比N大10,所以RO3-是ClO3-。进而可推出说法A、B是正确的,说明D是错误的。氯酸根离子既可以被氧化(转化为高氯酸根离子)、也可以被还原成低价态,所以说法C也是错误的。答案为AB。
[例3]1999年美国《科学》杂志报道:在40GPa高压下,用激光器加热到1800K,人们成功制得了原子晶体干冰,下列推断中不正确的是( )。
(A)原子晶体干冰有很高的熔点、沸点,有很大的硬度
(B)原子晶体干冰易气化,可用作制冷材料
(C)原子晶体干冰的硬度大,可用作耐磨材料
(D)每摩尔原子晶体干冰中含4molC-O键
[解析]解答前,应先弄清命题者是要考查干冰的性质、还是要考查原子晶体的性质。有的同学没有分析清楚这一点,认为是考查干冰的性质,因而造成错解。
通过“原子晶体干冰”来考测解题者对“原子晶体性质”的理解程度。原子晶体硬度大、熔点和沸点高,所以A和C两种说法正确。联想到二氧化硅晶体结构,可得出D说法也是正确的。答案应选B。
[例4]不同元素的原子在分子内吸引电子的能力大小可用一定数值x来表示,若x越大,其原子吸引电子的能力越强,在所形成的分子中成为负电荷一方。
下面是某些短周期元素的x值:
|
元素符号 |
Li |
Be |
B |
C |
O |
F |
Na |
Al |
Si |
P |
S |
Cl |
|
x值 |
0.98 |
1.57 |
2.04 |
2.55 |
3.44 |
3.98 |
0.93 |
1.61 |
1.90 |
2.19 |
2.58 |
3.16 |
(1)通过分析x值变化规律,确定N、Mg的x值范围:
_______________<x(Mg)<____________,______________<x(N)<___________________。
(2)推测x值与原子半径的关系是________________________________;根据短周期元素的x值变化特点,体现了元素性质的_________________变化规律。
(3)某有机化合物结构式为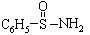 ,其中S-N中,你认为共用电子对偏向谁?_______(写原子名称)。
,其中S-N中,你认为共用电子对偏向谁?_______(写原子名称)。
(4)经验规律告诉我们:当成键的两原子相应元素的差值(Δx),当Δx>1.7时,一般为离子键,当Δx<1.7时,一般为共价键,试推断AlBr3中化学键类型是________________。
(5)预测元素周期表中,x值最小的元素位置:______________(放射性元素除外)。
[解析]题中给出第二、第三周期元素的x值(其中缺少了氮、镁两种元素的x值),x值与这种原子在分子中吸收电子的能力有关。
可根据元素性质的周期性变化来推测镁和氮的x值。从表中数值可看出,同周期中元素的x值随原子半径的减少而增大,x值的变化体现了元素性质的周期变化。
用x值大小可判断共价键中共用电子对偏向哪一方。对于S-N,由于N的x值大于S的x值,所以其中共用电子对偏向N原子。
表中查不到溴的x值,可根据元素周期律来推测,氯与溴同主族,氯的x值必定比溴的x值大,而:
x(Cl)-x(Al)=3.16-1.61=1.45<1.7,而溴与铝的x值这差必定小于1.45,所以溴化铝肯定属于共价化物。
x值越小,元素的金属越强,x值最小的元素应位于第六周期的IA主族。
所以答案为:(1)0.93<x(Mg)<1.61,2.55<x(N)<3.44。(2)同周期(同主族)中,x值越大,其原子半径越小;周期性。(3)氮原子。(4)共价键。(5)第六周期IA主族。
[预测与训练]
3.各类晶体主要特征
在离子晶体、原子晶体和金属晶体中均不存在分子,因此NaCl、SiO2等均为化学式。只有分子晶体中才存在分子。
|
类型 比较 |
离子晶体 |
原子晶体 |
分子晶体 |
金属晶体 |
|
|
构成晶体微粒 |
阴、阳离子 |
原子 |
分子 |
金属阳离子、自由电子 |
|
|
形成晶体作用力 |
离子键 |
共价键 |
范德华力 |
微粒间的静电作用 |
|
|
物理性质 |
熔沸点 |
较高 |
很高 |
低 |
有高、有低 |
|
硬度 |
硬而脆 |
大 |
小 |
有高、有低 |
|
|
导电性 |
不良(熔融或水溶液中导电) |
绝缘、半导体 |
不良 |
良导体 |
|
|
传热性 |
不良 |
不良 |
不良 |
良 |
|
|
延展性 |
不良 |
不良 |
不良 |
良 |
|
|
溶解性 |
易溶于极性溶剂,难溶于有机溶剂 |
不溶于任何溶剂 |
极性分子易溶于极性溶剂;非极性分子易溶于非极性溶剂中 |
一般不溶于溶剂,钠等可 与水、醇类、酸类反应 |
|
|
典型实例 |
NaOH、NaCl |
金刚石 |
P4、干冰、硫 |
钠、铝、铁 |
2.对一些重要的知识点加以总结归纳
如,在元素周期律的学习中用多种方法判断元素的金属性和元素的非金属性,并加以归纳总结。
金属性强弱:(1)单质与水或非氧化性酸反应难易;(2)单质的还原性(或离子的氧化性);(3)M(OH)n的碱性;(4)置换反应;(5)原电池中正负极判断,金属腐蚀难易;(4)对应金属离子电解时阴极放电顺序。
非金属性强弱:(1)与氢气反应生成气态氢化物难易;(2)单质的氧化性(或离子的还原性);(3)最高价氧化物的水化物(HnROm)的酸性强弱;(4)置换反应。
1.原子结构和元素周期律知识的综合网络
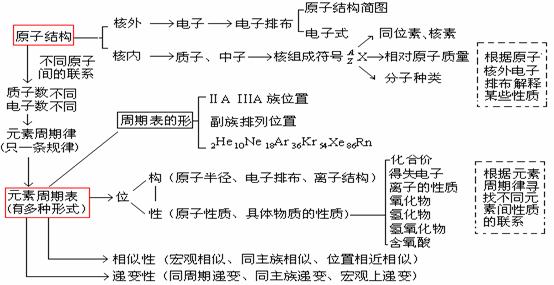
3.要注意,这部分内容也属于最重要基础知识之一,可以联系到各部分内容中,编制成多种不同的题型进行考查。
[复习重点]
2.《考试大纲》中有关物质结构部分的内容还有:
(1)理解离子键、共价键的涵义。理解极性键和非极性键。了解极性分子和非极性分子。了解分子间作用力,初步了解氢键。能用有关原理解释一些实际问题。
(2)了解几种晶体类型(离子晶体、原子晶体、分子晶体和金属晶体)及其性质,了解各类晶体内部微粒间的相互作用。能够根据晶体的性质判断晶体类型等。
(3)能对原子、分子、化学键等微观结构进行三维空间想像,重视理论联系实际、用物质结构理论解释一些具体问题。
高考试题中常常是结合元素化合物内容进行综合考查。题型上看可以是选的择题、简答题、填空题等。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com