
题目列表(包括答案和解析)
20. 若pH=3的酸溶液和pH=11的碱溶液等体积混合后溶液呈酸性,其原因可能是
若pH=3的酸溶液和pH=11的碱溶液等体积混合后溶液呈酸性,其原因可能是
 A.弱酸溶液和强碱溶液反应 B.生成了一种强酸弱碱盐
A.弱酸溶液和强碱溶液反应 B.生成了一种强酸弱碱盐
 C.强酸溶液和弱碱溶液反应 D.一元强酸溶液和一元强碱溶液反应
C.强酸溶液和弱碱溶液反应 D.一元强酸溶液和一元强碱溶液反应
19. 一定量的盐酸跟过量的铁粉反应时,为了减缓反应速率,且不影响生成氢气的总
一定量的盐酸跟过量的铁粉反应时,为了减缓反应速率,且不影响生成氢气的总
 量,可向盐酸中加入适量的 ①NaOH固体 ②H2O ③NH4Cl固体 ④CH3COONa
量,可向盐酸中加入适量的 ①NaOH固体 ②H2O ③NH4Cl固体 ④CH3COONa
 固体 ⑤NaNO3溶液 ⑥KCl溶液
固体 ⑤NaNO3溶液 ⑥KCl溶液
 A.②④⑤⑥
B.①② C.②③⑤ D.②④⑥
A.②④⑤⑥
B.①② C.②③⑤ D.②④⑥
18.
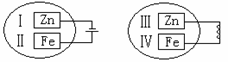 把锌片和铁片放在盛有稀食盐水和酚酞试液混合溶液的玻璃皿中,经过一段时间后,
把锌片和铁片放在盛有稀食盐水和酚酞试液混合溶液的玻璃皿中,经过一段时间后,
 首先观察到溶液变红的区域是
首先观察到溶液变红的区域是
 A、Ⅰ和Ⅲ附近 B、Ⅰ和Ⅳ附近
A、Ⅰ和Ⅲ附近 B、Ⅰ和Ⅳ附近
 C、Ⅱ和Ⅲ附近 D、Ⅱ和Ⅳ附近
C、Ⅱ和Ⅲ附近 D、Ⅱ和Ⅳ附近
17. 下列叙述正确的是
下列叙述正确的是
 A.0.1mol·L-1氨水中,c(OH-)=c(NH4+)
A.0.1mol·L-1氨水中,c(OH-)=c(NH4+)
 B.室温下,10 mL 0.02mol·L-1HCl溶液与10 mL 0.02mol·L-1Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=13
B.室温下,10 mL 0.02mol·L-1HCl溶液与10 mL 0.02mol·L-1Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=13
 C.在0.1mol·L-1CH3COONa溶液中,c(OH-)=c(CH3COOH)+c(H+)
C.在0.1mol·L-1CH3COONa溶液中,c(OH-)=c(CH3COOH)+c(H+)
 D.0.1mol·L-1某二元弱酸强碱盐NaHA溶液中,c(Na+)=c(HA-)
D.0.1mol·L-1某二元弱酸强碱盐NaHA溶液中,c(Na+)=c(HA-)
16. 某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(图中P表示压强,T表示温度,n表示物质的量):
某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(图中P表示压强,T表示温度,n表示物质的量):

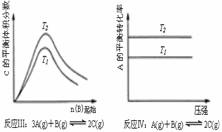
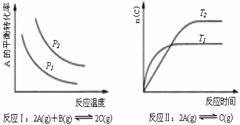





 根据以上规律判断,下列结论正确的是
根据以上规律判断,下列结论正确的是
 A.反应Ⅰ:△H>0,P2>P1
B.反应Ⅱ:T1>T2,△H<0
A.反应Ⅰ:△H>0,P2>P1
B.反应Ⅱ:T1>T2,△H<0
 C.反应Ⅲ:△H>0,T2=T1 D.反应Ⅳ:△H<0,T2>T1
C.反应Ⅲ:△H>0,T2=T1 D.反应Ⅳ:△H<0,T2>T1
15. 在一个2.0L密闭容器中,把2.0mol气体X和2.0mol气体Y相混合,在一定条件下发生了下列可逆反应:3X(g)+Y(g)
在一个2.0L密闭容器中,把2.0mol气体X和2.0mol气体Y相混合,在一定条件下发生了下列可逆反应:3X(g)+Y(g)  xQ(g)+2R(g)
xQ(g)+2R(g)
 当反应达平衡时,生成0.8molR,并测得Q的浓度为0.4mol/L.下列叙述中正确的是
当反应达平衡时,生成0.8molR,并测得Q的浓度为0.4mol/L.下列叙述中正确的是
 A.x的值为3
B.Y的平衡浓度为0.2mol/L
A.x的值为3
B.Y的平衡浓度为0.2mol/L
 C.X的转化率为60%
D.X的平衡浓度为0.6mol/L
C.X的转化率为60%
D.X的平衡浓度为0.6mol/L
14. 某溶液中在25℃由水电离出的氢离子浓度为1×10-13mol/L,下列说法正确的是
某溶液中在25℃由水电离出的氢离子浓度为1×10-13mol/L,下列说法正确的是
A.HCO3-、HS-、HPO42- 等离子在该溶液中不能大量共存 B.该溶液的pH一定等于12
C.向该溶液中加入铝片后,一定能生成氢气 D.若该溶液的溶质只有一种,它一定是碱
13.下列离子方程式或表达正确的是
A.CO2的水溶液中的电离平衡:CO2+
H2O H2CO3
H2CO3 2H+
+ CO32-
2H+
+ CO32-
B.NH4Cl溶液显酸性的原因:NH4+ + H2O  NH3·H2O +
H+
NH3·H2O +
H+
C.NaHCO3溶液水解离子方程式:HCO3- + H2O CO32- + H3O+
CO32- + H3O+
D.不论是在中性溶液还是在酸、碱性溶液,水的离子积常数一定为1.0 × 10-14
12.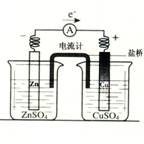 有关如右图所示原电池的叙述,正确的是
有关如右图所示原电池的叙述,正确的是
(盐桥中装有含琼胶的KCl饱和溶液)
A.铜片上有气泡逸出
B.取出盐桥后,电流计指针依然发生偏转
C.反应中,盐桥中的K+会移向CuSO4溶液
D.反应前后铜片质量不改变
11.相同温度下等物质的量浓度的下列溶液中,pH值最小的是
A.NH4C1 B.NH4HC03 C.NH4HS04 D.(NH4)2S04
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com