
题目列表(包括答案和解析)
1.基因芯片技术是近几年才发展起来的崭新技术,涉及生命科学、信息学、微电子学、材料学等众多的学科,固定在芯片上的各个探针是已知的单链DNA分子,而待测DNA分子用同位素或能发光的物质标记。如果这些待测的DNA分子中正好有能与芯片上的DNA配对的,它们就会结合起来,并在结合的位置发出荧光或者射线,即出现“反应信号”。下列说法中错误的是
A.基因芯片的工作原理是碱基互补配对
B.待测的DNA分子可以直接用基因芯片测序
C.基因芯片技术可用来筛选农作物的基因突变
D.基因芯片技术将来可以制作“基因身份证”
25. (8分)100mL某硝酸和硫酸的混合溶液中,加入50mL 4mol/L的NaOH溶液,正好完全中和,然后再取10mL原混合溶液,加入足量BaCl2的溶液,得沉淀1.165g。求:
(1)原混合溶液中H+的物质的量浓度。
(2)原溶液中所含HNO3的质量为多少。
银川市实验中学2009-2010学年度高三年级第一次月考
24.(8分)50mL密度为1.84g/cm3、质量分数为98%的浓H2SO4,其物质的量浓度为_____ ______;若将50mL该浓H2SO4稀释成密度为1.47g/cm3的溶液100mL,需水__________mL(ρ水=1g/cm3),稀释后溶液的质量分数为____________,物质的量浓度为____________。
23、(10分)有一种溶液,其中含有Ag+、Al3+、K+、Mg2+。
(1)向溶液中加入氯化钠溶液,现象为 。反应的离子方程式为 。
(2)将实验(1)所得溶液过滤,向滤液中加入过量氢氧化钠溶液,现象为
溶液中进行的反应的离子方程式为 、 、
。
(3)将实验所得的溶液过滤,向滤液中加入过量的盐酸,产生的现象为
反应的离子方程式 、 、
。
22. (9分)在下列物质NaCl、NaOH、Na2O2、H2O2、(NH4)2S、CCl4、C2H2、SiC、晶体硅、金刚石中:
① 其中只含有离子键的离子晶体是____________;
② 其中既有离子键,又有极性键和配位键的离子晶体是____________;
③ 其中既有离子键,又有非极性键的是_______________;
④ 其中既有离子键,又有极性键的离子晶体是_______________;
⑤ 其中含有非极性键的非极性分子的是________________;
⑥ 其中含有极性键的非极性分子的是_____________;
⑦ 其中含有非极性键的极性分子的是_____________;
⑧ 其中含有极性键的的原子晶体是_______________;
⑨ 其中含有非极性键的的原子晶体是_____________。
21. (5分)用20gNaOH配成250mL溶液,它的物质的量浓度为
。取出5mL该溶液,它的物质的量浓度为 ,再加水稀释至100mL,则稀释后溶液的物质的量浓度为
,其中含NaOH的质量为
。该100mL溶液可以跟浓度为0.1mol/L的硫酸溶液 mL完全中和。
(5分)用20gNaOH配成250mL溶液,它的物质的量浓度为
。取出5mL该溶液,它的物质的量浓度为 ,再加水稀释至100mL,则稀释后溶液的物质的量浓度为
,其中含NaOH的质量为
。该100mL溶液可以跟浓度为0.1mol/L的硫酸溶液 mL完全中和。
20.由10g不纯的CaCO3和足量盐酸反应在标准状况下,放出2.24L CO2,试推断杂质的组成( )
A. MgCO3和KHCO3 B. K2CO3和SiO2
C. MgCO3和SiO2 D. 无法确定
 请把第Ⅰ卷的选择题填在下表的相应位置
请把第Ⅰ卷的选择题填在下表的相应位置
第Ⅱ卷(非选择题 共40分)
18.在氢氧化钾溶液中,已知钾离子与水分子的物质的量之比为a : b,溶液的密度为d g/cm3,则溶液的浓度为 ( )
|
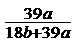 ×100% B.
×100% B.
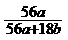 %
%
C. 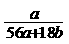 mol/L
D.
mol/L
D. 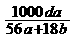 mol/L
mol/L
19由CO、H2和O2组成的混和气体60mL,在一定条件下恰好完全反应,测得生成物在101kPa,
120℃下对空气的相对密度为1.293,则原混和气体中H2所占的体积分数为( )
A.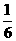 B.
B.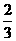 C.
C.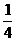 D.
D.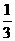
17. 240 g 5%的硫酸镁溶液,若蒸发掉 215.4 g水以后,剩下的水刚好形成硫酸镁晶体MgSO4·xH2O,则x值为 ( )
A.6 B.7 C.8 D.10
16.一个真空瓶,其质量为120 g,充满CO2后称量其质量为124.4 g,如改充满CO在相同条件下,气体与瓶的质量共为 ( )
A.121.2g B.122.2g C.122.8g D.124.0g
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com