
题目列表(包括答案和解析)
5、下列有关硫酸工业制法的说法中错误的是
A、预热从接触室出来的混合气体,有利于被浓硫酸吸收
B、黄铁矿在加入沸腾炉前需粉碎,其目的是提高原料的利用率
C、SO2氧化为SO3时需要使用催化剂,这样可以加快其反应速率
D、用98.3%的硫酸吸收SO3,而不用H2O或稀硫酸吸收SO3
4、X、Y、Z、M代表四种金属元素、金属X和Z用导线连接放入稀硫酸中时,X溶解,Z极上有氢气放出;若电解Y2+和Z2+离子共存的溶液时,Y先析出;又知M2+离子的氧化性强于Y2+离子,则这四种金属的活动性由强到弱的顺序为
A、X>Z>Y>M B、X>Y>Z>M C、M>Z>X>Y D、X>Z>M>Y
3、下列变化一定需要加入还原剂才能实现的是
A、KMnO4→ MnO2 B、Cl- → Cl2 C、H2S → SO2 D、Fe2+ → Fe
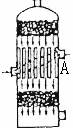
2、在硫酸工业生产中,为了有利于SO2的转化,且能充分利用热能,采用了中间有
热交换器的接触室(右图)。按此密闭体系中气体的流向,则在A处流出的气体为
A、SO2 B、 SO3,O2 C、SO2,SO3 D、SO2,O2
1、下列叙述正确的是
A、分子晶体中一定存在共价键 B、离子晶体中一定有金属元素
 C、原子晶体中一定不存在离子键 D、晶体中有阳离子就一定有阴离子
C、原子晶体中一定不存在离子键 D、晶体中有阳离子就一定有阴离子
25. (10分)向100mLBaCl2、AlCl3和FeCl3的
(10分)向100mLBaCl2、AlCl3和FeCl3的
混合溶液A中,逐滴加入Na2SO4和NaOH
的混合溶液B,产生的沉淀总物质的量和加
入溶液B的体积关系如右图所示:
(1)当加入B溶液110 mL时,溶液中的
沉淀是______________(填化学式)。
(2)溶液B中Na2SO4与NaOH的物质的
量浓度之比____________;从90 mL至
100 mL之间加入10 mL B溶液时所发生
的离子反应方程式是_________ 。
(3)将A.B溶液中各溶质的物质的量浓度填入下表:
|
溶质 |
Na2SO4 |
NaOH |
BaCl2 |
AlCl3 |
FeCl3 |
浓度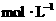 |
|
|
|
|
|
24.(5分)一定质量的氧化镁和氧化钙的混合物刚好与10倍质量的盐酸完全反应,试求盐酸中溶质的质量分数。
23.(10分)已知单质铁溶于-定浓度的硝酸溶液中反应的离子方程式为:
aFe+bNO3-+cH+=dFe2++fFe3++gNO↑+hN2O↑+kH2O(化学计量数a-k均为正整数)。
回答下列问题:
(1)根据反应中氮、氢、氧三种元素的原子个数守恒,可得C.g、h的关系式是(用-个代数式表示。下同) 。
(2)根据反应中离子的电荷守恒,可得B.C.D.f的关系式是 。
(3)根据反应中电子转移的总数相等,可得D.f、g、h的关系式是 。
(4)若a=12,且铁和稀硝酸恰好完全反应,则b的取值范围是 ;
c的取值范围是 。
22.(12分)(1)已知下列反应在一定条件下可以发生:
H2O2+4Fe2++2H+ 2Fe3++2H2O H2O2+2Fe3+ 2Fe2++O2↑+2H+
在以上反应中Fe2+实际上起着 作用,总反应为 。
(2)I2与Fe2+一样也能发生上述类似反应,类比(1)写出合适的化学反应方程式:
H2O2+I2 2HIO,
,总反应为
。
(3)在H2SO4和KI的混合溶液中加入足量的H2O2,放出大量的无色气体,溶液呈棕色,
并可以使淀粉溶液变蓝。有学生认为该反应的离子方程式为:H2O2+2I- I2+O2↑+2H+,这个方程式正确吗? 。若正确,理由是(若认为不正确,该步不必作答)
。若不正确,写出正确的化学反应方程式(若是离子反应,写出离子反应方程式,没有离子反应的,写出化学反应方程式):
。
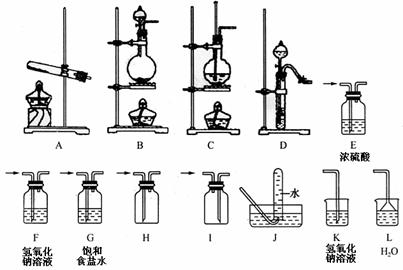
21.(8分)某校化学课外活动小组组装了下列仪器,如图所示。欲经过简单连接,制备中学化学中几种常见气体。
请填写下列表格中的空白:
|
序号 |
气体 |
装置的连接顺序(用编号表示) |
按要求填试剂名称 |
实验室制备该气体的化学反应方程式(是离子反应的要写出离子反应方程式) |
|
(1) |
CO2 |
制备→收集 ( )→( ) |
|
|
|
(2) |
NH3 |
制备→收集→尾气处理 ( )→( )→( ) |
若干燥NH3可选用的试剂 |
|
|
(3) |
Cl2 |
制备→净化→干燥→收集 →尾气处理 ( )→( )→( ) →( )→( ) |
处理尾气的试剂 |
|
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com