
题目列表(包括答案和解析)
6、下列有关反应热的说法正确的是
A.一个化学反应是否能在常温下发生与该反应的△H值的大小没有必然联系
B.中和热△H=-57.3kJ·mol-1,所以1.00L 1.00 mol-1H2SO4与稀的NaOH溶液恰好完全反应时放出57.3kJ的热量
C.用等体积的0.5mol/L盐酸、0.55mol/L NaOH溶液进行中和热测定的实验,会使测得的值偏大
D.在101kPa时1mol CH4完全燃烧生成CO2和水蒸气放出的热量就是CH4的燃烧热
5、高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,是比Cl2、O3、ClO2、KMnO4氧化性更强,无二次污染的绿色水处理剂。工业上是先制得高铁酸钠,然后在低温下,在高铁酸钠溶液中加入KOH至饱和就可析出高铁酸钾(K2FeO4)。
湿法制备的主要反应方程为:2Fe(OH)3+3ClO―+4OH―=2FeO42-+3Cl―+5H2O
干法制备的主要反应方程为:2FeSO4+4Na2O2=2Na2FeO4 +2Na2SO4
下列有关说法不正确的是( )
A.高铁酸钾中铁显+3价
B.湿法中每生成1mol Na2FeO4转移3 mol电子
C.干法中每生成1mol Na2FeO4转移4 mol电子
D.K2FeO4处理水时,不仅能消毒杀菌,还能吸附水中的悬浮杂质
4、将a%的某物质的水溶液加热蒸发掉m g水(溶质不挥发、且蒸发过程无溶质析出),所得溶液体积为V L,溶质的质量分数为蒸发前的2倍,设溶质的相对分子质量为M,则蒸发后所得溶液的物质的量浓度为( )
A.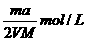 B.
B.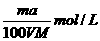 C.
C.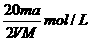 D.
D.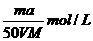
3、下列实验操作会导致实验结果偏低的是 ( )
①配制100 g 10%的CuSO4溶液,称取10 g 硫酸铜晶体溶于90 g水中
②测定碳酸钠晶体中结晶水的百分含量时,所用的晶体已经受潮
③配制一定物质的量浓度的溶液时,药品与砝码放反了,游码读数为0.2 g,所得溶液的浓度
④用酸式滴定管量取用98%,密度为1.84 g/cm3的浓H2SO4配制200mL 2 mol·L-1的稀H2SO4时,先平视后仰视
A.只有① B.只有② C.②③④ D.①③④
2、已知a g气体X2中含有b个X原子,那么c g该气体在0℃、1.01×105 Pa条件下的体积是(NA表示阿伏加德罗常数的值) ( )
A.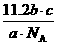 L
B.
L
B.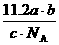 L
C.
L
C.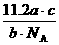 L D.
L D.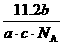 L
L
1、重水A和普通水B分别跟足量的金属钠反应,下列说法正确的是 ( )
A.A、B质量相等时,产生气体的体积在同温、同压下相等
B.A、B质量相等时,产生气体的质量相等
C.A、B的物质的量相等时,产生气体的体积在同温、同压下相等
D.A、B的物质的量相等时,产生气体的质量在同温、同压下相等
22、(12分)某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用下图所示装置先进行了有关实验:

(1)B是用来收集实验中产生的气体的装置,但未将导管画全,请直接在原图上把导管补充完整。
(2)实验中他们取6.4g铜片和12mL 18mol·L 浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。填写下列空格:
浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。填写下列空格:
①请写出铜跟浓硫酸反应的化学方程式:________________________________________________________。
②为什么有一定量的余酸但未能使铜片完全溶解,你认为原因是:_____________________
______________________________________________________________________________________________________________________________________。
③下列药品中能够用来证明反应结束后的烧瓶中确有余酸的是____________ (填写字母编号,有几个写几个,多写或写错0分)。
A.铁粉 B.BaCl2溶液 C.银粉 D.Na2CO3溶液
(3)如果测得标准状况下产生SO2的体积为1.792L,则被还原的硫酸的物质的量为 mol。
(4)有同学认为该实验装置存在不足之处,如何改进: 。(画出改进装置)
23(8分)、某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定测定其浓度。
(1) 滴定
滴定
①用酸式滴定管盛装c mol/L盐酸标准液。右图表示某 次滴定时50 mL滴定管中滴定前后液面的位置。用去的标准盐酸的体积为 mL。
②下表是4种常见指示剂的变色范围:
|
指示剂 |
石蕊 |
甲基橙 |
酚酞 |
|
变色范围(pH) |
5.0-8.0 |
3.1-4.4 |
8.2-10.0 |
该实验应选用 作指示剂;
③有关数据记录如下:
|
滴定序号 |
待测液体积(mL) |
所消耗盐酸标准液的体积(mL) |
||
|
滴定前 |
滴定后 |
消耗的体积 |
||
|
1 |
V |
0.50 |
25.80 |
25.30 |
|
2 |
V |
6.00 |
31.35 |
25.35 |
(2)根据1、2所给数据,写出计算烧碱样品的物质的量浓度的表达式(不必化简)
c = 。
(3)对下列几种假定情况进行讨论:(填“无影响”、“偏高”、“偏低”)
a.若滴定前用蒸馏水冲洗锥形瓶,则会使测定结果 ;
b.读数时,若滴定前仰视,滴定后俯视,则会使测定结果 ;
c.滴加盐酸速度过快,未充分振荡,刚看到溶液变色,立刻停止滴定,则会使测定结果 。
21、(12分) A、B、C、D四种短周期元素的原子序数依次增大。A、D同族,B、C同周期,A与B组成的化合物甲为气态,其中A、B原子个数比为4∶1。由A与C组成的两种化合物乙与丙均为液态,乙中A、C原子个数比为1∶1,丙中为2∶1。由D与C组成的两种化合
物丁和戊都为固态,丁中D、C原子数之比为1∶1,戊中为2∶1。
(1)甲分子构型_______________ ;乙的电子式_______________ ;
丁中存在的化学键类型_______________
(2)写出B元素最高价氧化物与丁发生反应的化学方程式: _____。
(3)A、B、C、D四种元素中某三种组成的化合物的水溶液能与金属铝反应放出氢气,写出反应的化学方程式: 。
(4)由A、B、C、D四种元素形成的化合物中,有一些化合物的水溶液呈碱性。从已学过的
化合物中试写出一种,并用离子方程式表示其呈碱性的原因。___________;_____________________________。
20、(6)一定量的氢气在氯气中燃烧,所得混合物用100mL 3.00mol/L的NaOH溶液(密度为1.12g/mL)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.0500mol。
(1)原NaOH溶液的质量分数为
(2)所得溶液中Cl-的物质的量为 mol单位
(3)所用氯气和参加反应的氢气的物质的量之比n(Cl2):n(H2)= 。
19. (8分) 向一定量的浓硝酸里①加入过量的铜,开始反应发生的化学方程式
反应一段时间后,硝酸浓度会变稀,反应的离子方程式 反应中硝酸的作用是 和
②加入红热的碳,反应的化学方程式
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com