
题目列表(包括答案和解析)
6.CuS和Cu2S都能溶于硝酸,它们高温灼烧的产物相同,以下鉴别CuS和Cu2S两种黑色粉末的方法合理的是
A.将两种样品分别溶于硝酸,区别所产生的气体
B.将两种样品分别溶于硝酸,区别溶液的颜色
C.取两种同质量的样品分别在高温灼烧,区别残留固体的质量
D.取两种同质量的样品分别在高温灼烧,区别残留固体的颜色
5.在加入铝粉能放出H2的溶液中,分别加入下列各组离子,肯定不能大量共存的是
A. Fe3+、NO3-、Cl-、Na+ B.Ba2+、Mg2+、HCO3-、AlO2-
C.NO3-、Na+、K+、CO32- D.NO3-、K+、AlO2-、OH-
4.已知:①向KMnO4晶体滴加浓盐酸,产生黄绿色气体;②向FeCl2溶液中通入少量实验①产生的气体,溶液变黄色;③取实验②生成的溶液滴在淀粉KI试纸上,试纸变蓝色。下列判断正确的是
A.上述实验证明氧化性:MnO4->Cl2>Fe3+>I2
B.上述实验中,共有两个氧化还原反应
C.实验①生成的气体不能使湿润的淀粉KI试纸变蓝
D.实验②证明Fe2+既有氧化性又有还原性
3、用NA代表阿伏加德罗常数,下列说法正确的是
A 0.5 mol Al与足量盐酸反应转移电子数为1 NA
B 标准状况下,11.2 L SO3所含的分子数为0.5 NA
C 0.1 mol CH4所含的电子数为1 NA
D 46 g NO2和N2O4的混合物含有的分子数为1 NA
2、下列叙述正确的是
A 直径介于1 nm-100 nm间的微粒称为胶体 B 胶体粒子很小可以透过半透膜
C 利用丁达尔效应可以区别溶液与胶体 D 电泳现象可证明胶体属电解质溶液
1.下列化合物不能通过化合反应获得的是
A.CuS B.Na2O2 C.Fe(OH)3 D.FeS
30.(14分)
I.(9分)
某研究小组成员在讨论鉴别浓硫酸和稀硫酸的方案时,设计了如下方案:
|
|
操作 |
结论 |
|
甲 |
火柴梗 |
变黑者为浓硫酸 |
|
乙 |
加入金属铝片 |
产生刺激性气味者为浓硫酸 |
|
丙 |
分别加入到盛水的试管中 |
放热者为浓硫酸 |
|
丁 |
用玻璃棒蘸浓氨水靠近盛酸的瓶口 |
冒白烟者为浓硫酸 |
|
戊 |
加到 晶体中 晶体中 |
变白者为浓硫酸 |
请回答下列问题:
(1)其中可行的是 。
(2)其中一个稍作改进就能成为可行的是 ,改进方法是
。
(3)完全错误的是 ,因为 。
II.(5分)
另一研究小组成员从化学手册上查知硫酸铜在500℃以上按下式分解:
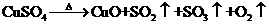 ,便决定设计一个验证性实验探究测定反应产生的
,便决定设计一个验证性实验探究测定反应产生的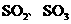 。和O2的物质的量,并经计算确定该条件下CuSO4分解反应方程式中各物质的化学计量数。实验可能用到的仪器如图8所示:(假定每步吸收都是完全的)
。和O2的物质的量,并经计算确定该条件下CuSO4分解反应方程式中各物质的化学计量数。实验可能用到的仪器如图8所示:(假定每步吸收都是完全的)
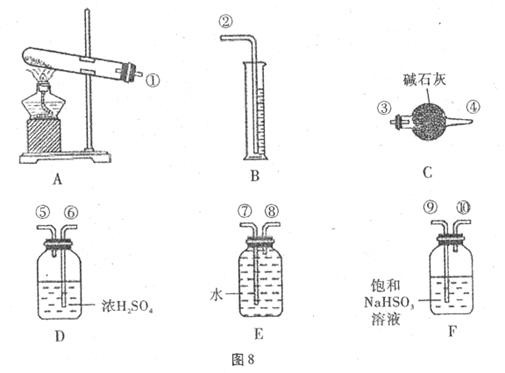
实验测得数据及有关结果如下:
①准确称取12.0g无水CuSO4;
②干燥管总质量在实验结束时增加了m g;
③测出量筒中水的体积后,折算成标准状况下气体的体积为560mL;
④实验结束时,装置F中的溶液变为NaHSO4溶液(不含其他溶质)。
试回答下列问题:
(1)按装置从左到右的方向,各仪器接口连接顺序为 (每种装置只使用一次)。
(2)通过计算m= g,推断出该条件下反应的化学方程式:
。



29.(10分)
图7中,A、C是工业上用途很广的两种重要的酸和碱,B为日常生活中常见的金属,H、G是正四面体结构的非极性分子,H是一种重要的气体能源,J是一种耐高温材料,K是由常见元素组成的化合物(图中部分反应物或生成物没有列出)。请按要求回答:
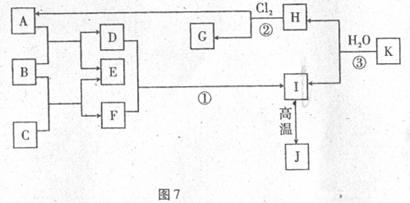
(1)写出B的名称 ,G的化学式 ,K的化学式 。
(2)反应①的离子方程式为 。
(3)写出B和C反应的离子方程式 。
28.(6分)
臭氧与氧气的关系为 ,O3有非常强的氧化性,将少量臭氧通入KI溶液中,发现有以下现象:溶液颜色变成黄色,并测得溶液的pH大于7,同时有一种无色无味的气体放出,该气体能使带火星的木条复燃。写出上述反应的化学方程式 ,
1mol O3发生反应时,转移的电子为 mol。
27.(10分)
A、B、C是短周期主族元素,且原子序数依次增大,A元素的原子最外层电子数是次外层电子数的3倍,B和C的原子序数之和是A的原子序数的3倍,B和C形成的离子具有相同的电子层结构。试回答下列问题:
(1)C离子的结构示意图是 ;由A和B形成的含有非极性键的离子化合物的电子式是 :
(2)B离子半径 (填“<”或“>”)C离子半径,B和C元素最高价氧化物的水化物之间反应的离子方程式为 ;
(3)化合物X由元素A、B、C组成,写出X的溶液与过量盐酸反应的离子方程式:
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com