
题目列表(包括答案和解析)
12.锂电池反应原理如下:FePO4+Li
 LiFePO4,内部为能够导电的固体电解质。下列有关该电池说法正确的是
LiFePO4,内部为能够导电的固体电解质。下列有关该电池说法正确的是
..... (A)可加入硫酸以提高电解质的导电性
..... (B)放电时电池内部Li+向负极移动.
..... (C)充电过程中,电池正极材料的质量增加
..... (D)放电时电池正极反应为:FePO4 +e-+Li+ =LiFePO4
11.实验室将NaClO3和Na2SO3按物质的量比2:1倒入烧瓶中,用水浴加热,同时滴入H2SO4溶液,产生棕黄色的气体X,反应后测得NaClO3和Na2SO3恰好完全反应,则X为
(A)Cl2 (B)Cl2O (C)ClO2 (D) Cl2O3
10.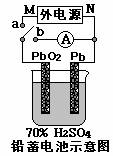 铅蓄电池是一种可充放电的原电池,总反应方程式如下:
铅蓄电池是一种可充放电的原电池,总反应方程式如下:
Pb+PbO2+2H2SO4  2PbSO4+2H2O。如图装置,
2PbSO4+2H2O。如图装置,
下列分析正确的是
(A)放电时正极反应:Pb-2e-+SO42- = PbSO4;
(B)放电溶液时正极的PH降低;
(C)充电时连接处N为直流电源的负极;
(D)充电时阴极的反应为:PbO2+4e-+4H++SO42-= PbSO4+2H2O
9.化学在生产和日常生活中有着重要的应用。不正确的说法是
(A)明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化
(B)在海轮外壳上镶入锌块,可减缓船体的腐蚀速率
(C)MgO的熔点很高,可用于制作耐高温材料
(D) 电解MgCl2饱和溶液,可制得金属镁
8.从原理看,下列六种制备方案中,不合理或不宜采用的是
①加热稀硫酸和乙醇制备乙烯; ②稀盐酸和二氧化锰共热制备氯气;
③用稀硫酸和大理石制备CO2; ④稀硝酸和亚硫酸钠制备SO2;
⑤加热氯化铵与氢氧化钙稀溶液混合物制取氨气;
⑥向煮沸的1 mol·L-1 NaOH溶液中滴加FeCl3饱和溶液制备Fe(OH)3胶体。
(A)①②; (B)②③⑤⑥; (C)③④⑤⑥; (D)①②③④⑤⑥;
7.亚硝酸HNO2为一弱酸,下列实验设计能说明亚硝酸为弱酸的是
①测试NaNO2溶液PH>7; ②测试0.1mol/LHNO2溶液PH<7;
③测试同浓度HNO3和HNO2导电性亚硝酸导电性差;
④测试比较HNO2溶液加入固体NaNO2溶解前后溶液PH;
⑤NaHCO3溶液中加入0.1mol/LHNO2溶液产生CO2气泡。
(A)①②③⑤;(B)③④⑤;(C)①③④;(D)②⑤
6.某溶液中含有K+、NH4+、Fe2+、Al3+、Cl-等5种离子,若向其中加入过量的氢氧化钠溶液,微热并搅拌,再加入过量的盐酸溶液,则溶液中离子数目大量减少的是
(A)只有NH4+; (B)Fe2+和Al3+;
(C)NH4+ 和Fe2+ ; (D)NH4+、Fe2+、Al3+
5.下列离方程式书写正确的是
(A)石灰乳与Na2CO3溶液混合:Ca2++CO32-=CaCO3↓
(B)NH4HSO3溶液与足量的NaOH溶液混合加热:
NH4++HSO3-+2OH- NH3Ÿ+SO32-+2H2O
NH3Ÿ+SO32-+2H2O
(C)酸性条件下KIO3溶液与KI溶液发生反应生成I2:
IO3-+5I-+3H2O=3I2+6OH-
(D)AgNO3溶液中加入过量的氨水:Ag++NH3·H2O=AgOH +NH4+
4.一定条件下,某无色溶液与NH4HCO3作用能产生气体,此溶液中可能大量共存的离子组是
(A) Cu2+、Mg2+、Cl-、SO42- (B) Al3+、K+、Cl-、NO3-
(C) Na+、Ba2+、NO3-、OH-; (D) K+、I-、NO3-、SO42-;
3.下列做法中用到物质氧化性的是
(A)明矾净化水 (B)纯碱除去油污
(C)臭氧消毒餐具 (D)食醋清洗水垢
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com