
题目列表(包括答案和解析)
1.下列关于化学学习和研究的说法错误的是
A.化学模型有助于解释一些化学现象
B.质量守恒定律是大量实验事实的总结
C.化学家提出的假设都能被实验证实
D.化学基本原理的应用是有一定条件的
21.(14分)某研究性小组借助A-D的仪器装置完成有关实验
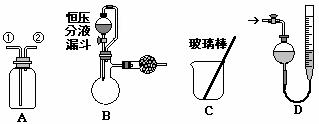
[实验一]用装置A收集纯净的相对氢气,正确的操作是 (填序号)。
a.从①口进气,用排水法集气 ; b.从①口进气,用排气法集气
c.从②口进气,用排水法集气 ; d.从②口进气,用排气法集气
[实验二]镀锌薄铁板广泛应用于工农业生产。
(1)镀锌铁片镀层破坏后在酸雨污染的潮湿空气中发生电化学腐蚀,其电极反应主要为:负极:__________________;正极____________________;
为了探究镀锌薄铁板上的锌的质量分数ω(Zn)和镀层厚度,查询得知锌易溶于碱:Zn+2NaOH=Na2ZnO3+H2↑ 据此,截取面积为S的双面镀锌薄铁板试样,剪碎、称得质量为m1 g。用固体烧碱和水作试剂,拟出下列实验方案并进行相关实验。www.
方案甲:通过测量试样与碱反应生成的氢气体积来实现探究木目标。
(2)选用B和 (填仪器标号)两个装置进行实验。
(3)测得充分反应后生成氢气的体积为VL(标准状况),ω(Zn)= 。
(4)计算镀层厚度,还需要检索的一个物理量是 。
(5)若装置B中的恒压分液漏斗改为普通分液漏斗,测量结果将 。
(填“偏大”、“偏小”或“无影响”)。
方案乙:通过称量试样与碱反应前后的质量实现探究目标。选用仪器C做实验,试样经充分反应,滤出不溶物、洗涤、烘干,称得其质量为m2g 。
(6)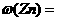 。
。
方案丙:通过称量试样与碱反应前后仪器、试样和试剂的总质量(其差值即为H2的质量)实现探究目标。实验同样使用仪器C。
(7)从实验误差角度分析,方案丙 方案乙(填“优于”、“劣于”或“等同于”)。
20.(14分)下图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的MSO4溶液100g 5.00%的K2SO4溶液和氢氧化铁液溶胶,电极均为石墨电极。
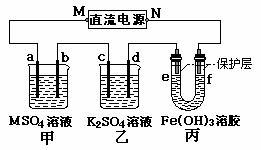
(1)接通电源,经过一段时间后,测得甲中a电极质量增加。乙中K2SO4浓度为10.47%,据此回答问题:
①电源的N端为 极;电极b上发生的电极反应为 ;
②列式计算电极d上生成的气体在标准状态下的体积 ;
若M为铜,则电极a的质量变化是 g;
③丙中e附近的现象是 ;
(2)欲通过该装置确定MSO4溶液中金属M的原子量,一段时间后,测得b电极产生的气体为VmL(标准状况下),a电极析出金属M为m g,则金属M的原子量表示为______________。www.
为精确测定电极上析出金属M的质量,所必需的实验步骤的先后顺序应是 。(选填下列操作步骤的编号)
①称量电解前电极质量 ②刮下电解后电极上的铜并清洗
③用蒸馏水清洗电解后电极 ④低温烘干电极后称量
⑤低温烘干刮下的铜后称量 ⑥再次低温烘干后称量至恒重
19.(6分)通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。www.
|
化学键 |
Si-O |
Si-Cl |
H-H |
H-Cl |
Si-Si |
Si-C |
|
键能/kJ·mol-1 |
460 |
360 |
436 |
431 |
176 |
347 |
请回答下列问题:
(1)比较下列两组物质的熔点高低(填“>”或“<”)
SiC Si; SiCl4 SiO2
(2)工业上高纯硅可通过下列反应制取:
SiCl4(g) + 2H2(g) 高温 Si(s) + 4 HCl(g)该反应的反应热△H = kJ/mol.
18.(8分)几种常见物质的转化关系如下:将D溶液滴入沸
水中可得到以F为分散质的红褐色液溶胶体G。F为红棕
色沉淀。
(1)下列说法正确的是__________;
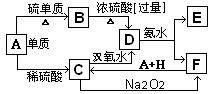 ①G中分散质粒子直径范围为1nm-100nm;
①G中分散质粒子直径范围为1nm-100nm;
②用光束照射可鉴别G液体和D溶液;
③向G液体中加入BaCl2溶液无沉淀产生;
④将G液体通电时阳极附近颜色加深;
⑤向G液体中加NaHCO3会有气泡产生;
⑥A、B、H的化学式分别为Fe、FeS、H2SO4;
(2)C的酸性溶液与双氧水反应的离子方程式: 。
(3)将SO2通往D物质的溶液中,溶液P明显下降且颜色呈淡绿色,离子方程式为: 。
(4)C溶液加入浓NaOH溶液通入Cl2气可制新型水处理剂Na2FeO4;配平并标注电子转移方向和数目:
 □ Fe2++ □OH-+ □Cl2
= □FeO42- + □Cl- + □
□ Fe2++ □OH-+ □Cl2
= □FeO42- + □Cl- + □
17.(10分)工业上使用重晶石制备BaCl2的工艺流程图如下:
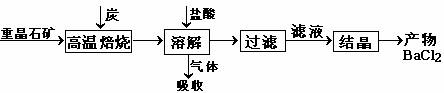
实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验。查表得
BaSO4(s)
+ 4C(s) 4CO(g) + BaS(s)
△H1 = +571.2 kJ·mol-1 ①
4CO(g) + BaS(s)
△H1 = +571.2 kJ·mol-1 ①
BaSO4(s)
+ 2C(s) 2CO2(g) + BaS(s) △H2=
+226.2 kJ·mol-1 ②
2CO2(g) + BaS(s) △H2=
+226.2 kJ·mol-1 ②
(1)气体用过量NaOH溶液吸收得到硫化钠。用惰性电极电解Na2S水溶液可回收到单质硫,同时又得到NaOH溶液。试写出两极的电极方程式:
阳极 。
阴极 。
(2)反应C(s) + CO2(g) 2CO(g) 的△H2= kJ·mol-1。
2CO(g) 的△H2= kJ·mol-1。
(3)实际生产中必须加入过量的炭,同时还要通入适量空气,其目的是:
。
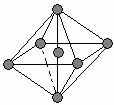 (4)BaS晶体结构类似氯化钠晶体结构,在晶体中存在七个
(4)BaS晶体结构类似氯化钠晶体结构,在晶体中存在七个
离子组成的最小正八面体结构单元,这七个离子中Ba2+
与S2-的个数比为_________。
16.已知:2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ/mol
Na2O2(s)(s)+CO2(g)=Na2CO3(s)+1/2O2(g)ΔH=-226 kJ/mol
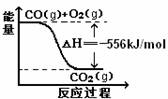 根据以上热化学方程式判断,下列说法正确的是
根据以上热化学方程式判断,下列说法正确的是
(A)CO的燃烧热为283 kJ;
(B)右图可表示由CO生成CO2的反应过程和能量关系
(C)2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g)
ΔH > -452 kJ/mol
(D)CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023
15.碳常见三种单质:金刚石、石墨、C60。据此推测下列叙述正确的是
(A)三种晶体燃烧生成1molCO2气体放出的热量相同;
(B)三种晶体碳原子均形成了C-C四键,均有很高的熔点和沸点;
(C)三种晶体中金刚石和石墨不溶解于有机溶剂;
(D)三种晶体中C60能导电,广泛用做电极材料;
14.用数学方法研究化学有时很方便。下列数轴表示的化学事实错误的是
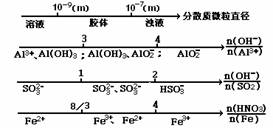 (A)分散系的分类:
(A)分散系的分类:
(B)AlCl3与NaOH
作用,铝元素存在形式:
(C)NaOH吸收SO2
阴离子的存在形式:
(D)铁与稀硝酸作用 存在形式
13.已知在热的碱性溶液中,NaClO发生如下反应:3NaClO 2NaCl+NaClO3。在相同条件下NaClO2也能发生类似的反应,其最终产物是
2NaCl+NaClO3。在相同条件下NaClO2也能发生类似的反应,其最终产物是
(A)NaCl、NaClO (B)NaCl、NaClO3
(C)NaClO、NaClO3 (D)NaClO3、NaClO4
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com