
题目列表(包括答案和解析)
8. A、B两元素均是短周期元素,以下判断中错误的是网
A、若A、B同主族,且能形成离子化合物,则该化合物一定能与水反应
B、若A、B同主族。且能形成原子晶体,则其熔点一定大于硅晶体
C、若A、B同周期,且质子数A>B,则Am+的离子半径一定大于Bn+
D、若A在第三周期,且Am+与Bn-具有相同的核外电子排布,则B在第二周期
7. 可逆反应: 得到平衡后,下列叙述正确的是
得到平衡后,下列叙述正确的是
A、增大压强,平衡不移动,说明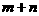 一定等于
一定等于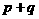 高
高
B、若增加B的量,体系颜色加深,说明B必是气体考
C、升高温度,A的转化率减小,说明正反应是吸热反应资
D、若B是气体,增大A的量,A、B转化率一定都增大源
6. 下列离子方程式正确的是
A、硫化钠和稀硫酸反应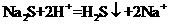
B、氢氧化钡溶液和稀硫酸反应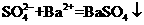
C、氯气与水反应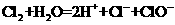
D、亚硫酸钡与盐酸反应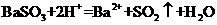
5. 某强酸溶液和某强碱溶液等体积混合后,所得溶液的pH值为7,原酸溶液和原碱溶液的摩尔浓度
A、大于 B、小于 C、等于 D、不能肯定
4. 单项X和Y相互反应生成化合物X2+Y2-。现有下列叙述:①X被氧化;②X是氧化剂;③X具有氧化性;④XY既是氧化产物又是还原产物;⑤XY中的Y2-具有还原性;⑥XY中的X2+具有氧化性;⑦Y的氧化性比XY中的X2+的氧化性强。以上叙述中正确的是
A、①④⑤⑥⑦ B、①③④⑤ C、②④⑤ D、①②⑤⑥⑦
3. 离子 与
与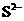 能在酸性溶液中发生如下反应:
能在酸性溶液中发生如下反应:
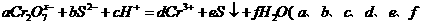 均为化学剂量数),若
均为化学剂量数),若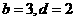 ,则
,则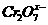 中
中 的化合价为
的化合价为
A、+4价 B、+5价 C、+6价 D、+7价
2. 下列说法正确的是(NA表示阿伏加德罗常数)
A、1mol乙醇分子中含有NA个极性共价键
B、16g氧气所含分子个数为NA
C、常温常压下1mol氖含有原子数为NA
D、常温常压下11.2L氯气含有的分子数为0.5NA
1. 实验室利用氧化--还原反应制取的气体是
(1) (2)
(2)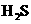 (3)
(3) (4)CO2 (5)
(4)CO2 (5)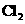 (6)NO
(6)NO
A、(1)(3)(5) B、(2)(5)(6)
C、(3)(4)(5) D、(3)(5)(6)
23.(10分)化学实验是探究化学原理的主要手段。
(1)为了探究钠跟非金属的反应,有人进行如下实验:观察用刀切开的钠的表面所发生的变化。把一小块钠放在石棉网上加热,观察发生的现象。
从钠的化学性质角度分析你认为通过本实验可探究得出什么结论?
。
实验中主要用了什么方法? 。
(2)为了探究钠跟水的反应,进一步进行两个实验:
①向一个盛有水的小烧杯里滴入几滴酚酞试液,然后把绿豆大的一块钠投入小烧杯中。
②切一小块绿豆大的钠,用铝箔(事先用针刺一此小孔)包好,再用镊子夹住,放在试管口下,用排水法收集气体。待试管中气体集满时,小心取出试管,把试管口向下移近酒精灯火焰,检验生成的气体。
根据实验①的现象可判断,钠跟水反应后的产物之一是 ,根据实验②的现象判断,钠跟水反应的产物之一是 ,综合起来可得钠跟水反应的化学反应原理,请用离子方程式表示 。24.(10分)A、B、C、D是按原子序数由小到大排列的第二、三周期元素的单质。B、E均为组成空气的成分。F的焰色反应呈黄色。在G中,非金属元素与金属元素的原子个数比为1:2。在一定条件下各物质之间的相互转化关系如下图(图中部分产物未列出):
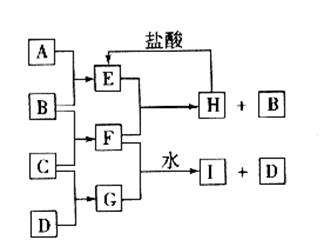
请填写下列空白
(1)A是 ,C是 。(写化学式)
(2)H与盐酸反应生成E的化学方程式是 。
(3)E与F反应的化学方程式是 。
(4)F与G的水溶液反应生成I和D的离子方程式是
;
22.(8分)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用氧化气法提纯,其反应式为:
(1)配平下列反应的化学方程式:
 C+ K2Cr2O7+ H2SO4 CO2↑+ Cr2(SO4)3+ K2SO4+ H2O
C+ K2Cr2O7+ H2SO4 CO2↑+ Cr2(SO4)3+ K2SO4+ H2O
(2)反应的氧化剂是 ,氧化产物是 ;
(3)H2SO4在上述反应中表现出来的性质是 (填选项编号)
A.酸性 B.氧化性 C.吸水性 D.脱水性
(4)上述反应中若产生0.2molCO2气体,则转移电子的物质的量是 mol。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com