
题目列表(包括答案和解析)
7. 当电解质溶液为氢氧化钾水溶液的氢氧燃料电池电解饱和碳酸钠溶液一段时间,假设电解时温度不变且用惰性电极,下列说法正确的是
 A.当电池负极消耗mg气体时,电解池阳极同时有mg气体生成
A.当电池负极消耗mg气体时,电解池阳极同时有mg气体生成
B.电池的正极反应式为:O2 + 2H2O + 4e- = 4OH-
C.电解后c(Na2CO3)不变,且溶液中有晶体析出
D.电池中c(KOH)不变;电池中溶液pH变大
6. 以下现象与电化腐蚀无关的是
A.黄铜(铜锌合金)制作的铜锣不易产生铜绿
B.生铁比软铁芯(几乎为纯铁)容易生锈
C.铁质器件附有铜质配件,在接触处易生铁锈
D.银质奖牌长期放置后在其奖牌的表面变暗
4. 氢镍电池是一种应用广泛的可充电电池,它可以取代会产生镉污染的镉镍电池。氢镍电
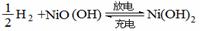 池的总反应为
。据此判断,下列叙述中正确的是( )
池的总反应为
。据此判断,下列叙述中正确的是( )
A.电池放电时,H2是正极 B.电池放电时,溶液中的阳离子移向正极
C.电池充电时,氢元素被氧化 D.电池放电时,电池负极周围溶液的pH不断增大
 5.右图是工业电解饱和食盐水的装置示意图,下列有关说法中不正确的是( )
5.右图是工业电解饱和食盐水的装置示意图,下列有关说法中不正确的是( )
A.装置中出口①处的物质是氯气,出
口②处的物质是氢气
B.该离子交换膜只能让阳离子通过,
不能让阴离子通过
C.装置中发生反应的离子方程式为:
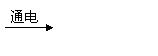
2C1-+2H+ Cl2↑+H2↑
D.该装置是将电能转化为化学能
3.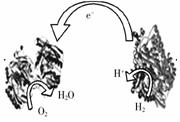 2006年,科学家们发明了一种能够给电子设备提供动力的 生物燃料电池。该电池包括两个涂覆着酶的电极,它们处于充满空气和少量氢气的玻璃槽中。由于气体可以混合从而省去了昂贵的燃料隔离膜,其工作原理如图所示。下列说法正确的是(
)
2006年,科学家们发明了一种能够给电子设备提供动力的 生物燃料电池。该电池包括两个涂覆着酶的电极,它们处于充满空气和少量氢气的玻璃槽中。由于气体可以混合从而省去了昂贵的燃料隔离膜,其工作原理如图所示。下列说法正确的是(
)
A.左边为该电池的负极 B.该电池可在高温环境下使用
C.该电池负极反应为:H2-2e-=2H+
D.该电池正极反应为O2+4e-=2O2-
2. 1L0.1mol/LAgNO3溶液在以Fe作阳极,Ag作阴极的电解槽中电解,当阴极增重2.16g时,下列判断正确的是(设电解按理论进行,溶液不蒸发) ( )
A.溶液的浓度不变 B.阳极上产生112mLO2(标准状况)
C.转移的电子数是1.204×1022个 D.反应中有0.02mol的Ag+被氧化
1.如图所示,下列叙述正确的是( )
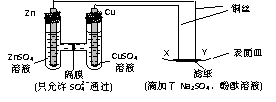

A.Y为阴极,发生还原反应 B.X为正极,发生氧化反应
C.Y与滤纸接触处有O2生成 D.X与滤纸接触处变红
23、(10分)已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测其离子浓度大小顺序可能有如下四种关系:
① c(Cl-)> c(NH4+)> c(H+)> c(OH-)
② c(NH4+)> c(OH-)>c(Cl-)> c(H+)
③ c(NH4+)> c(Cl-)> c(OH-)> c(H+)
④ c(Cl-) > c(H+) > c(NH4+)> c(OH-)
填写下列空白:
(1) 若溶液中只溶解一种溶质,则该溶质是_________ ,上述四种离子浓度的大小顺序为(填序号)____ ;
(2) 若四种离子的关系符合③,则溶质为______ __ _ ;
若四种离子的关系符合④,则溶质为______ ___ ;
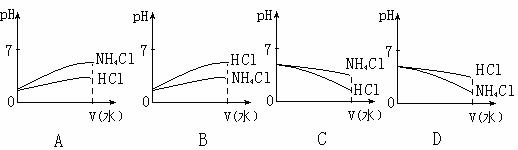
(3)将pH相同的NH4Cl溶液和HCl溶液稀释相同的倍数,则下面图像正确的是(填图像符号) ;
(4) 若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前
c(HCl) __ c(NH3·H2O)(填“大于”、“小于”或“等于”,下同);混合前酸中
 c(H+)和碱中c(OH-)的关系为c(H+)_ ___ c(OH-)。
c(H+)和碱中c(OH-)的关系为c(H+)_ ___ c(OH-)。
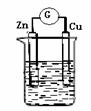
(5) 如右图所示,烧杯中盛放的溶液为盐酸, 接通电流表G后,
指针发生偏转,则负极材料是 ,正极反应式是
。
22、(11分)由短周期元素构成的常见离子,它们组成A、B、C、D四种物质,分别溶于水。已知:
①A、C的焰色反应呈黄色
②取A、B溶液,分别加入BaCl2溶液,均生成白色沉淀,再加入稀HNO3,A中沉淀溶解,并产生能使澄清石灰水变浑浊的无色、无臭气体,而B中无变化。
③在D的稀溶液中加入AgNO3溶液和稀HNO3,有白色沉淀生成。
④在D溶液中滴加C溶液,生成白色沉淀,继续滴入C,白色沉淀消失。
⑤A、B、C溶液的物质的量浓度相等,当A、B溶液以体积比1∶2混合时,生成无色气体;B、C溶液以体积比1∶2混合时,也生成无色气体,此气体能使湿润的红色石蕊试纸变蓝色;如果均以体积比1∶1混合,两者都不生成气体。
写出化学式:
A____________,B____________,C____________,D____________。
写出D溶液中不断滴入C溶液的离子方程式:________________________________________。
21、(9分)向某密闭容器中加人 0 . 3 molA 、 0 . 1 molC 和一定量的 B 三种气体。一定条件下发生反应,各物质浓度随时间变化如下图中甲图所示。附图中乙图为 t2时刻后改变容器中条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件,所用条件均不同。已知, t3 ~t4阶段为使用催化剂[已知 t0~ t1阶段 c ( B)未画出] 。
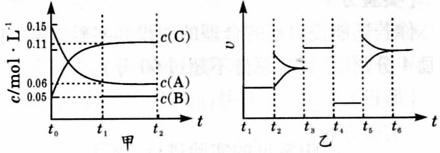
( 1 )若 t1= 15 s ,则t0~ t1阶段以 C 浓度变化表示的反应速率为v( C )=______________。
( 2 ) t4 ~t5阶段改变的条件为____________ , B 的起始物质的量为_________。
( 3 ) t5 ~t6阶段容器内 A 的物质的量共减少 0 . 03 mol ,而此过程中容器与外界的热交换总量为 akJ ,写出该反应的热化学方程式:
___________________________________ ;
20、(10分)下图Ⅰ、Ⅱ、Ⅲ是常见的气体发生装置;IV、V、VI是气体收集装置,根据要求回答下列问题:
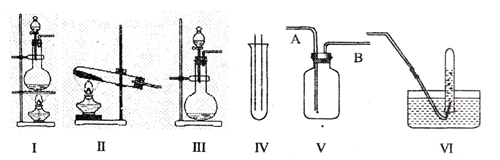
(1)若用MnO2与浓盐酸反应制取氯气,应选用装置 ,用方程式表示的制取氯气的反应原理是 _ ___ ___ ___ ___ 。
(2)若用KMnO4与浓盐酸反应制取氯气,应选用的装置 ,试完成并配平下列离子方程式:
MnO4-+ C1-+ H+- Mn2++
C12↑+ 。
(3)若选用IV为氯气的收集装置,应该在试管口放置一团棉花,该棉花团应用
溶液浸湿,其作用是 。
(4)若选用V为氯气收集装置,则氯气应从 口通入。用化学方法检验氯气收集满了的方法是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com