
题目列表(包括答案和解析)
20、元素X的单质及X与Y形成的化合物能按如下图所示的关系发生转化。则X为
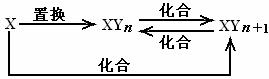
A.当n=1时,X可能是Mg B.当n=1时,X可能是N2
C.当n=2时,X可能是S D.当n=2时,X可能是Fe
19、在下列各溶液中,离子一定能大量共存的是………………………………( )
A.强碱性溶液中:K+、Al3+、Cl-、SO42-
B.含有0.1 mol·L-1 Fe3+的溶液中:K+、Mg2+、I-、NO3-
C.含有0.1 mol·L-1Ca2+的溶液中:Na+、K+、CO32-、Cl-
D.室温下,pH=1的溶液中:Na+、Fe3+、NO3-、SO42-
18、下列各组物质的晶体中,化学键类型相同、晶体类型、物质发生状态变化所克服的粒子间的相互作用也相同的是…………………………………………………………( )
A.SO3和SiO2 B.CCl4和KCl C.NaCl和HCl D.CO2和H2O
17、下列热化学方程式书写正确的是(△H的绝对值均正确)
A.C2H5OH(l) + 3O2(g) = 2CO2(g) + 3H2O(g);△H=-1367.0 kJ/mol(燃烧热)
B.NaOH(aq) + HCl(aq) = NaCl(aq) + H2O(l);△H=+57.3 kJ/mol(中和热)
C.S(s) + O2(g) = SO2(g);△H=-269.8 kJ/mol(反应热)
D.2NO2 = O2 + 2NO;△H=+116.2 kJ/mol(反应热)
16、下列离子方程式中,书写正确的是…………………………………………( )
A.向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3+ + 3H2O Fe(OH)3↓+
3H+
Fe(OH)3↓+
3H+
B.用小苏打治疗胃酸过多:HCO3- + H+ = CO2↑+ H2O
C.实验室用浓盐酸与MnO2反应制Cl2:MnO2 + 2H+
+ 2Cl- Cl2↑+
Mn2+ + H2O
Cl2↑+
Mn2+ + H2O
D.用FeCl3溶液腐蚀印刷电路板:Fe3+ + Cu = Fe2+ + Cu2+
15、下列化合物,按其晶体的熔点由高到低排列正确的是……………………( )
A.金刚石 晶体Si Na Mg B.SiO2 CsCl CBr4 CF4
C.HI HBr HCl HF D.CsCl RbCl KCl NaCl
14、常温下,在下列溶液中发生如下反应:
①16H+
+ 10Z- + 2XO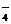 = 2X2+
+ 5Z2 + 8H2O
= 2X2+
+ 5Z2 + 8H2O
②2A2+ + B2 = 2A3+ + 2B-
③2B- + Z2 = B2 + 2Z-
由此判断下列说法错误的是………………………………………………………( )
A.Z元素在反应①③中均被还原
 B.反应Z2
+ 2A2+ = 2A3+
+ 2Z-可以进行
B.反应Z2
+ 2A2+ = 2A3+
+ 2Z-可以进行
C.氧化性由强到弱的顺序是:XO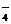 、Z2、B2、A3+
、Z2、B2、A3+
D.还原性由强到弱的顺序是:A2+、B-、Z-、X2+
13、设阿伏加德罗常数(NA)的数值为nA,下列说法正确的是………………( )
A.1 mol Cl2与足量H2反应,形成的共价数为nA
B.0.5 mol Na2O2中含有的质子总数为19nA
C.常温常压下的33.6 L氯气与27 g铝充分反应,转移电子数为3nA
D.标准状况下,11.2 L的SO3所含分子数为0.5nA
12、将m1 g锌加到m2 g 20% HCl溶液中去,反应结果共放出n L氢气(在标准状况下),则被还原的HCl的物质的量是…………………………………………………………( )
A.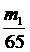 mol B.
mol B.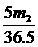 mol C.
mol C.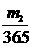 mol D.
mol D.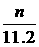 mol
mol
11、氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛用于电子工业、陶瓷工业等领域。在一定条件下,氮化铝可通过反应Al2O3 + N2 + 3C 2AlN
+ 3CO合成。下列叙述正确的是…………………………………………………………………( )
2AlN
+ 3CO合成。下列叙述正确的是…………………………………………………………………( )
A.反应中,N2是还原剂,Al2O3是氧化剂
B.反应中,每生成2 mol AlN,N2得到3 mol电子
C.氮化铝中氮元素的化合价为-3
D.AlN的摩尔质量为41 g
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com