
题目列表(包括答案和解析)
4. NA 代表阿伏加德罗常数,下列叙述错误的是( )
A. 10 mL 质量分数为 98 %的 H2SO4,用水稀释至 100 mL , H2SO4 的质量分数为 9.8 %
B. 在 H2O2 + Cl2 = 2HCl + O2 反应中,每生成 32g氧气,则转移 2 NA 个电子
C .标准状况下,分子数为NA的 CO 、C2H4 混合气体体积约为 22 . 4L ,质量为 28g
D .一定温度下, 1 L 0.5 mol/L NH4Cl 溶液与 2 L 0. 25mol/L NH4Cl 溶液含NH4+ 物质的量不同
3. 由Fe(OH)3、NaCl、Ag2O、CaCO3、Al(OH)3组成的固体混合物,请用五种试剂逐一将这五种物质溶解而分离,这五种试剂依次是
A. 水、NaOH溶液、CO2、稀氨水、HCl溶液
B. NaOH溶液、水、稀氨水、CO2、HCl溶液
C. 水、NaOH溶液、稀氨水、CO2、HCl溶液
D.  稀氨水、水、NaOH溶液、CO2、HCl溶液
稀氨水、水、NaOH溶液、CO2、HCl溶液
2. 下列除去杂质的方法正确的是
A、除去N2中的少量O2:通过灼热的CuO粉末,收集气体
B、除去FeCl3溶液中的少量FeCl2:加入加入稍过量的双氧水后放置
C、除去KCl溶液中的少量K2CO3:加入过量的BaCl2溶液,过滤
D、除去NaCl溶液中的少量MgCl2:加入适量KOH溶液,过滤
1. 从绿色化学的理念出发,下列实验宜用如图所示装置进行的是
从绿色化学的理念出发,下列实验宜用如图所示装置进行的是
①.不同浓度的硝酸与铜的反应 ②.稀硫酸与纯碱或小苏打反应
③.铝与氢氧化钠溶液或稀盐酸反应 ④.H2O2在不同催化剂作用下分解
A.①② B.②③ C.③④ D.②④
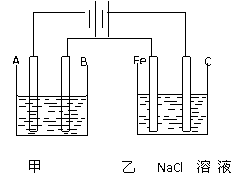
26、(10分)如图为相互串联的甲乙两个电解池,请回答:
(1)甲池若为用电解原理给铁片镀铜的装置,电镀液为 ,
待镀的铁片作 极(填“阴”“阳”),为图中的 极(填“A”“B”)
(2)乙池中若滴入少量酚酞试液,开始一段时间后,Fe极附近呈___________色。
(3)若甲槽阴极增重12.8g,则乙槽阳极放出气体在标准状况下的体积为_________。
(4)若乙槽剩余液体为400mL,则电解后得到碱液的物质的量浓度为_______,pH为_____
25、(6分)密闭容器中,800℃时反应2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:

(1)写出该反应的平衡常数表达式:K=___________________。
已知:K(300℃)>K(350℃),该反应是________热反应。
(2)右图中表示NO2的变化的曲线是____________。
用O2表示从0-2s内该反应的平均速率v=___________。
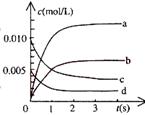
(3)能说明该反应已经达到平衡状态的是___________。
a、v(NO2)=2v(O2) b、容器内压强保持不变
c、v逆(NO)=2v正(O2) d、容器内的密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是__________。
a、及时分离出NO2气体 b、适当升高温度
c、增大O2的浓度 d、选择高效的催化剂
24、(8分)W、X、Y、Z是原子序数依次增大的同一短同期元素,W、X是金属元素,Y、Z是非金属元素,Y元素的单质在常温下为淡黄色固体。
(1)W、X各自的最高价氧化物对应的水化物可以反应生盐,该反应的离子方程式为________________ ____。
(2)X的硝酸盐水溶液显______性,用离子方程式解释原因____ _______
_____________。
(3)比较Y、Z气态氢化物的稳定性_____>_______(用分子式表示)
(4)Z的最高价氧化物为无色液体,0.25 mol该物质与一定量水混合得到一种稀溶液,并放出QkJ的热量。写出该反应的热化学方程式:_______________________。
23、(5分)Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液。(1)该电池的负极材料是 。电池工作时,电子流向 极(填“正”“负”)(2)若ZnCl2-NH4Cl混合溶液中含有杂质Cu2+,会加速电极的腐蚀,其主要原因是
。欲除去Cu2+最好选用下列试剂中的
(a NaOH b Zn c Fe d NH3•H2O)
22、(2分)已知 Cl2 + 2NaOH == NaCl + NaClO + H2O ,现有瓶NaOH溶液, 质量分数为14%( 其密度为1.14 g/ml)则这种溶液 升能与2.24升(标况下)Cl2恰好完全反应。
21、(2分)298K 100kPa时,NH3(g)+HCl(g)==NH4Cl(s) ΔH1=-176kJ·mol-1
N2(g)+3H2(g)==2NH3(g)ΔH2=-92.2 kJ·mol-1
H2(g)+Cl2(g)==2HCl(g)ΔH3=-184.6 kJ·mol-1
298K时的N2(g)+4H2(g)+Cl2(g)==2 NH4Cl(s) ΔH=
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com