
题目列表(包括答案和解析)
7.将物质的量均为a mol的钠和铝一同投入m g水中(水足量),所得溶液的密度为ρg·Cm-3,则此溶液的物质的量浓度为( )
A、mol/L B、mol/L C、mol/L D、mol/L
6.下列对“摩尔(mol)”的叙述不正确的是( )
A.摩尔是一个单位,用于计量物质所含微观粒子的多少
B.摩尔既能用来计量纯净物, 又能用来计量混合物
C.1mol任何气体所含的气体分子数目都相等
D.用“摩尔”(而不用“个”)计量微观粒子与用“纳米”(而不用“米”)计量原子直径,计量思路都是扩大单位
(1)写出D的电子式_______________________;
(2)由A转化为E,每消耗1molB,转移电子的物质的量为__________mol。
(3)常温下,将V1LA气体和V2LE气体同时通入水中,若所得溶液的pH=7,则V1______ V2(填“大于”、“小于”或“等于”).
30.(15分)石灰石的主要成份是CaCO3,此外还含有少量的SiO2、Fe2O3、Al2O3及MgO等。测定石灰石中钙、铝含量的方法如下:
取mg的粉末状样品溶于过量的盐酸并过滤,得滤液及不溶物A,用盐酸洗涤A,将洗涤液与滤液合并之,再将合并后的溶液平均分成B、C两等份。
(1)石灰石中钙含量的测定:
向B中加入过量的草酸铵溶液,再用适量的氨水调节溶液的pH约为4.5,此时溶液中的Ca2+转化为草酸钙沉淀,经过滤、洗净,用过量的稀硫酸溶解沉淀,再用浓度为amol/L的KMnO4溶液滴定生成的草酸,终点时耗去KMnO4溶液bmL.
滴定反应为:H2C2O4+MnO4-+H+→Mn2++CO2↑+H2O(未配平)。
①配平上述反应后,H+的化学计量数是__________。
②生成草酸钙的离子方程式是 ________________。
③石灰石中钙的质量分数 (Ca)=
(用含m、a、b的代数式表示)。
(Ca)=
(用含m、a、b的代数式表示)。
(2)石灰石中铝含量的测定:
向C中加入过量的D溶液并过滤,得滤液及不溶物,用D溶液洗涤不溶物,将洗涤液与滤液合并,向合并后的溶液中通入过量的无色、无气味的气体E,得白色沉淀F,经过滤、洗涤、充分灼烧、冷却,最终所提固体的质量为cg。
①D的化学式是______。
②通入气体E生成白色沉淀F的离子方程式是_________。
③石灰石中铝的质量分数 (Al)=____________(用含m、c的代数式表示)。
(Al)=____________(用含m、c的代数式表示)。

(1)A中含有的化学键为____________
(2)用化学方程式表示E在冶金工业上的一种重要用途_________;
(3)写出反应①的化学方程式_____________________________。
33. 已知某混合金属粉末中,除铝外还含有铁、铜中的一种或两种,所含金属的量都在5%以上。请设计合理实验探究该混合物金属粉末中铁、铜元素的存在。
已知某混合金属粉末中,除铝外还含有铁、铜中的一种或两种,所含金属的量都在5%以上。请设计合理实验探究该混合物金属粉末中铁、铜元素的存在。
 仅限选择的仪器和试剂:烧杯、试管、玻璃棒、量筒、容量瓶、滴管、药匙;1mol·L-1硫酸、2mol·L-2硝酸、2mol·NaOH溶液、20%KSCN溶液。
仅限选择的仪器和试剂:烧杯、试管、玻璃棒、量筒、容量瓶、滴管、药匙;1mol·L-1硫酸、2mol·L-2硝酸、2mol·NaOH溶液、20%KSCN溶液。
 完成以下实验探究过程:
完成以下实验探究过程:
 (1)提出假设:
(1)提出假设:
 假设1:该混合金属粉末中除铝外还含有 元素;
假设1:该混合金属粉末中除铝外还含有 元素;
 假设2:该混合金属粉末中除铝外还含有 元素;
假设2:该混合金属粉末中除铝外还含有 元素;
 假设3:该混合金属粉末中除铝外还含有Fe、Cu元素;
假设3:该混合金属粉末中除铝外还含有Fe、Cu元素;
 (2)设计实验方案基于假设3,设计出实验方案(不要在答题卡上作答)。
(2)设计实验方案基于假设3,设计出实验方案(不要在答题卡上作答)。
 (3)实验过程
(3)实验过程
 根据(2)的实验方案,叙述实验操作、预期现象和结论。
根据(2)的实验方案,叙述实验操作、预期现象和结论。
 [提示]Ⅰ.在答题卡上按以下方式作答,注意前后内容对应;
[提示]Ⅰ.在答题卡上按以下方式作答,注意前后内容对应;
32. 铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂
铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂
 等。
等。





 (1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式
。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式
。
 (2)若将(1)中的反应设计成原电池,请画出原电池的装置图,标出正、负极,并写出电极反应式。
(2)若将(1)中的反应设计成原电池,请画出原电池的装置图,标出正、负极,并写出电极反应式。

 正极反应
负投反应
。
正极反应
负投反应
。
 (3)腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10mol·L-1,请参照下表给出的数据和药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤
。
(3)腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10mol·L-1,请参照下表给出的数据和药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤
。
|
|
氢氧化物开始沉淀时的pH |
氢氧化物沉淀完全时的pH |
Fe3+ Fe2+ Fe2+ Cu2+ Cu2+ |
1.9 7.0 7.0 4.7 4.7 |
3.2 9.0 9.0 6.7 6.7 |
|
提供的药品:Cl2 浓H2SO4 NaOH溶液 CuO Cu |
(4)某科研人员发现劣质不锈钢在酸中腐蚀缓慢,但在某些盐溶液中腐蚀现象明显。请从上表提供的药品中选择两种(水可任选),设计最佳实验,验证劣质不锈钢易被腐蚀。
 有关反应的化学方程式
有关反应的化学方程式
 劣质不锈钢腐蚀的实验现象
劣质不锈钢腐蚀的实验现象
31. 铜是重要的工业原材料,现有Cu、Cu2O和CuO组成的混合物,某研究性学习小组为了探究其组成情况,向混合物中加入10mL 6mol·L-1HNO3溶液刚好使其溶解,同时收集到224mLNO气体(标准状况)。请回答下列问题:
铜是重要的工业原材料,现有Cu、Cu2O和CuO组成的混合物,某研究性学习小组为了探究其组成情况,向混合物中加入10mL 6mol·L-1HNO3溶液刚好使其溶解,同时收集到224mLNO气体(标准状况)。请回答下列问题:
 (1)写出Cu2O跟稀硝酸反应的化学反应方程式__________ __ 。(不必配平)
(1)写出Cu2O跟稀硝酸反应的化学反应方程式__________ __ 。(不必配平)
 (2)产物中硝酸铜的物质的量______________mol;
(2)产物中硝酸铜的物质的量______________mol;
 (3)如混合物中含0.01molCu,则其中Cu2O、CuO的物质的量分别是________mol、__________mol
(3)如混合物中含0.01molCu,则其中Cu2O、CuO的物质的量分别是________mol、__________mol
 (4)如混合物中Cu的物质的量为x,求x的取值范围________________。
(4)如混合物中Cu的物质的量为x,求x的取值范围________________。
30. 如图,盛有足量水的水槽里放两个烧杯,小烧杯里放有少量铜片和过量浓硝酸,小烧杯外面倒扣一个大烧杯,请回答:
如图,盛有足量水的水槽里放两个烧杯,小烧杯里放有少量铜片和过量浓硝酸,小烧杯外面倒扣一个大烧杯,请回答:

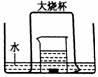 (1)铜与浓硝酸反应的化学方程式:_______________________;
(1)铜与浓硝酸反应的化学方程式:_______________________;
 (2)实验中观察到的主要现象是:
(2)实验中观察到的主要现象是:
 ①_______________________________ ;
①_______________________________ ;
 ②_______________________________ ;
②_______________________________ ;
 ③_______________________________ ;
③_______________________________ ;
 ④_______________________________ 。
④_______________________________ 。
 (3)用该装置做铜与浓硝酸反应实验的优点:______________
;
(3)用该装置做铜与浓硝酸反应实验的优点:______________
;

 (4)大烧杯内最终所得气体产物的化学式:
;若要验证此气体产物,最简便的方法:_________________________________________
。
(4)大烧杯内最终所得气体产物的化学式:
;若要验证此气体产物,最简便的方法:_________________________________________
。
29. 氯化铜(CuCl2·2H2O)中含FeCl2杂质.为制得纯净氯化铜晶体,首先将其制成水溶液,然后按下面所示操作步骤进行提纯.
氯化铜(CuCl2·2H2O)中含FeCl2杂质.为制得纯净氯化铜晶体,首先将其制成水溶液,然后按下面所示操作步骤进行提纯.






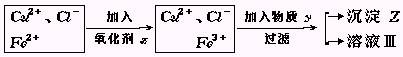
 ↓蒸发结晶
↓蒸发结晶
 CuCl2·2H2O(纯)
CuCl2·2H2O(纯)
 (1)加入氧化剂X的目的是
(1)加入氧化剂X的目的是
 (2)下列氧化剂中最适合本实验的是
(2)下列氧化剂中最适合本实验的是
 A.H2O2 B.KMnO4 C.NaClO D.K2Cr2O7
A.H2O2 B.KMnO4 C.NaClO D.K2Cr2O7
 (3)物质Y和沉淀Z的化学式分别是
和
.
(3)物质Y和沉淀Z的化学式分别是
和
.
 (已知完全成氢氧化物所需PH值:Fe3+为3.7,Cu2+为6.4,Fe2+为9.6.)
(已知完全成氢氧化物所需PH值:Fe3+为3.7,Cu2+为6.4,Fe2+为9.6.)
28. 试样x由氧化亚铁和氧化铜组成.取质量相等的两份试样,按下图所示进行实验.
试样x由氧化亚铁和氧化铜组成.取质量相等的两份试样,按下图所示进行实验.


 (1)请写出步骤③中所发生的全部反应的离子方程式.
(1)请写出步骤③中所发生的全部反应的离子方程式.
 (2)若全部的溶液y和全部的粉末Z充分反应后,生成的不溶物的质量是m,则每份试样x中氧化铜的质量为
(用m表示).
(2)若全部的溶液y和全部的粉末Z充分反应后,生成的不溶物的质量是m,则每份试样x中氧化铜的质量为
(用m表示).
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com