
题目列表(包括答案和解析)
30.(10分)2gCu2S和CuS的混合物在酸性溶液中用400mL0.075mol/LKMnO4溶液处理,反应均生成Cu2+、Mn2+、SO2和H2O,其中Cu2S与酸性KMnO4溶液反应的离子方程式为:
8MnO4-- + 5Cu2S + 44H+ == 10Cu2+ + 5SO2 + 8Mn2+ + 22H2O
反应后煮沸溶液,赶尽SO2,取出剩余溶液的十分之一用0.1mol/L(NH4)2Fe(SO4)2溶液滴定,终点时恰好用去35.00mL (NH4)2Fe(SO4)2溶液,反应的离子方程式为:
MnO4-- + 5Fe2+ + 8H+ == Mn2+ + 5Fe3+ + 4H2O
(1)写出该条件下CuS与酸性KMnO4溶液反应的离子方程式:
;在此反应中,若生成22.4LSO2(标准状况),则反应中转移的电子为 mol。
(2)欲配制500mL 0.1mol/L Fe2+溶液,需称取(NH4)2Fe(SO4)2•6H2O (M=392g/mol)的质量为 g,配制时所需要的定量仪器是 。
29.(11分)有X、Y、Z三种元素,已知:
① X2-、Y-均与Y的气态氢化物分子具有相同的电子数;
② Z与Y可组成化合物ZY3,ZY3溶液遇苯酚呈紫色。请回答:
(1)Y的最高价氧化物对应水化物的化学式是 。
(2)将ZY3溶液滴入沸水中可得到红褐色液体,反应的离子方程式是
_______________________ 。此液体具有的性质是 (填序号字母)。
a.光束通过该液体时形成光亮的“通路”
b.插入电极通直流电后,有一极附近液体颜色加深
c.向该液体中加入硝酸银溶液,无沉淀产生
d.将该液体加热、蒸干、灼烧后,有氧化物生成
(3)X单质在空气中燃烧生成一种无色有刺激性气味的气体。
① 已知一定条件下,每1mol该气体被O2氧化放热98.0kJ。若2mol该气体与1molO2在此条件下发生反应,达到平衡时放出的热量176.4kJ,则该气体的转化率为 。
② 原无色有刺激性气味的气体与含1.5molY的一种含氧酸(该酸的某盐常用于实验室制取氧气)的溶液在一定条件下反应,可生成一种强酸和一种氧化物,若有1.5×6.02×1023个电子转移时,该反应的化学方程式是 。
28.A、B、C、D是四种可溶于水的化合物,分别有阳离子K+、Ba2+、Al3+、Fe3+和阴离子OH-、CO32-、NO3-、SO42-两两组合而成,它们的溶液发生如下反应:
①A与B 反应生成白色沉淀,再加过量A,沉淀量减少,但不会完全消失。
②B与C 反应生成白色沉淀E和气体H;
③C与D 反应生成有色沉淀F和气体H。
(1)分别写出它们的化学式:
A B C D
E F H
(2)写出①中再加过量A沉淀量减少的离子方程式:
(3) 胶体F也是一种常用的化学物质,写出制备胶体F的离子方程式: ;提纯胶体F的方法: ;如果用胶体F做电泳实验, 极附近颜色加深。
27.(10分)过量的铁溶于稀硫酸可得硫酸亚铁。等物质的量的硫酸亚铁与硫酸铵作用,能生成溶解度较小的硫酸亚铁铵晶体[(NH4)2Fe(SO4)2·6H2O,浅绿色晶体],该晶体的商品名称为摩尔盐。
(1)写出上述反应的化学方程式。
(2)若用15 mL 3 mol/L硫酸来制备摩尔盐,计算生成摩尔盐的质量。
(3)为了测定某批次莫尔盐的纯度,取该产品23.52 g,配成100 mL溶液,取出10 mL用0.10 mol/L KMnO4溶液滴定,消耗KMnO4溶液10.00 mL。
①配平下列反应式:
Fe2++ MnO4-+ H+ - Mn2++ Fe3++
②试求产品中莫尔盐的质量分数 。
13.将标准状况下的某气体(摩尔质量为Mg•mol-1)溶于ag水中,所得到溶液的密度为bg•cm-3,物质的量浓度为cmol•L-1,则该气体溶入水中的体积是( )
A. B.
B. C.
C. D.
D.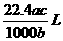
选择题答题表:
12.某学生用NaHCO3和KHCO3组成的某混合物与盐酸反应并进行实验,测得如下数据(盐酸的物质的量浓度相等)
|
|
50mL盐酸 |
50mL盐酸 |
50mL盐酸 |
|
m(混合物) |
9.2g |
15.7g |
27.6g |
|
V(CO2)(标况) |
2.24L |
3.36L |
3.36L |
则下列分析推理中不正确的是( )
A.盐酸的物质的量浓度为3.0mol·L-1
B.根据表中数据能计算出混合物中NaHCO3的质量分数
C.加入混合物9.2g时盐酸过量
D. 15.7g混合物恰好与盐酸完全反应
11.下列条件下,两瓶气体所含的原子数一定相等的是( )
①同质量不同密度的CO和N2 ②同温同体积的H2和Cl2
③同体积同密度的C2H4和C3H6 ④同压同体积的N2O和CO2
A.①③ B. ①② C. ②④ D. ③④
10.下列说法中正确的是(NA为阿伏加德罗常数)( )
A.1.5gCH3 +中含有的电子数NA
B.64g CaC2晶体中所含阴阳离子个数为2NA
C.4.48L氨气中一定含有0.6 NA个N-H键
D.常温下,100mL 1mol/L AlCl3溶液中阳离子总数等于0.1 NA
9.将15 mL 2 mol·L-1 Na2CO3溶液逐滴加入到40 mL 0.5 mol·L-1 MCln盐溶液中,恰好将溶液中的Mn+离子完全沉淀为碳酸盐,则MCln中n值是( )
A.4 B.3 C.2 D.1
8.甲物质氨水质量分数为1%的溶液与9%的溶液等体积混合,乙物质硝酸质量分数为1%的溶液与9%的溶液等体积混合,丙物质硫酸质量分数为1%的溶液与9%的溶液等质量混合,如下叙述正确的是( )
A.混合后,甲、乙、丙溶液中溶质的质量分数均大于5%
B.混合后,甲溶液溶质的质量分数小于5%,乙、丙溶液溶质的质量分数大于5%
C.混合后,甲溶液溶质的质量分数小于5%,乙的大于5%,丙的等于5%
D.混合后,甲、乙、丙溶液质量分数均等于5%
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com