
题目列表(包括答案和解析)
5.用NA表示阿伏加德罗常数,下列说法正确的是
A.5.6g铁与硫反应失去的电子数为0.3 NA
B.1 mol Na2O:与水反应转移电子数为NA
C.2.9g乙基(一C2H5)含有的电子数为1.8NA个
D.标准状况下,NA个NO、CO2、SO3分子所占的体积均约为22.4L
4. 如图所示,烧杯内装有蒸馏水,下部封有半透膜的长颈漏斗内装有淀粉和食盐溶液,漏斗颈内的液面略高于烧杯内蒸馏水的液面,过一段时间后用碘水和硝酸银溶液去检验。实验过程中,观察到的现象是
如图所示,烧杯内装有蒸馏水,下部封有半透膜的长颈漏斗内装有淀粉和食盐溶液,漏斗颈内的液面略高于烧杯内蒸馏水的液面,过一段时间后用碘水和硝酸银溶液去检验。实验过程中,观察到的现象是
A.烧杯内液体遇硝酸银溶液有白色沉淀生成
B.长颈漏斗内液体加碘水无明显变化
C.烧杯内液体遇碘水变蓝
D.漏斗颈内液面不变
3.下列说法或表示法正确的是
A.氢气与氧气反应生成等量的水蒸气和液态水,前者放出热量多
B.需要加热的反应说明它是吸热反应
C.在稀溶液中: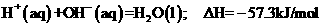 ,若将含0.5mol H2SO4的浓硫酸与含lmol NaOH的溶液混合,放出的热量大于57.3kJ
,若将含0.5mol H2SO4的浓硫酸与含lmol NaOH的溶液混合,放出的热量大于57.3kJ
D.1mol硫完全燃烧放热297.3kJ,其热化学方程式为:

2.下列叙述中,正确的是
A.原子晶体中只含有非极性键
B.金属在常温时都以金属晶体形式存在
C.离子晶体一定是由金属与非金属元素组成
D.分子晶体中一定有分子间作用力,有的还可能有氢键
1.随着汽车的增多,每天排放到大气中的废气(含有NO2)越来越多。下列现象的主要原因与排放NO2有关的是
A.硅肺病 B.臭氧层空洞 C.光化学烟雾 D.温室效应
30.(15分)右图是由Emil Zmaczynski设计的金字塔式元素周期表的一部分,图上标有ⅥA族和几种元素的位置。请回答下列问题:
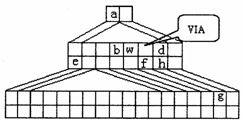 (1)请写出g元素在周期表中的位置_________,并将铁的元素符号填在上图中合适的位置。
(1)请写出g元素在周期表中的位置_________,并将铁的元素符号填在上图中合适的位置。
(2)下列叙述正确的是_________。
A.氢化物Hd比Hh稳定,H2f的沸点高于H2O
B.离子半径r(e)>r(f)>r(h) C.化合物bh4与bf2均为非极性分子
D.由图中标出的8种元素形成的10e-结构的阳离子只有Na+和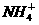
(3)已知由元素a、b、w组成的化合物abw可称为“氢某酸”,分子中各原子均达到稳定状态,试写出其电子式(请用其真实化学式填空)_____________;又知此酸对应的钾盐有剧毒,常温下其钾盐溶液的pH=9,则其溶液中由水电离出的c(OH-)=_________mol/L,该溶液中所有离子的浓度由大到小的顺序是(请用其真实化学式填空)_____________。
(4)元素e的某化合物固体呈淡黄色,该物质与e2f的溶液反应生成淡黄色沉淀(没有放出气体)。则反应的离子方程式为(请用其真实化学式填空)____________。
29.(18分)现有六种元素A、B、C、D、E、F均为周期表中前20号元素,且原子序数依次增大。已知A和B是形成化合物种类最多的两种元素;B元素和C元素通常形成电子数为14或22的化合物。D元素的原子半径是短周期主族元素中最大的;E元素在地壳中含量居第二位;F是组成人体骨骼的牙齿的主要元素。
请回答以下问题:
(1)请画出F的离子结构示意图: ;由C、A两种元素形成的18电子化合物的电子式为 ;
(2)工业上制取E单质的化学方程式为: ;
(3)由以上六种元素两两组合所形成的化合物中,既含有离子键又含有非极性共价键的常见化合物有 和 (填化学式);它们都能与水反应生成气体,写出其中一个属于非氧化化还原反应的化学方程式 ;
(4)由A、B两种元素形成的正四面体分子是一种常见的气体燃料。通常状况下1g该物质完全燃烧生成液态水时所释放的能量为51.25kg/mol,请写出表示其燃烧热的热化学方程式: ;
(5)下图是中学常见的几种晶体结构。有关说法正确的是 (填选项)。
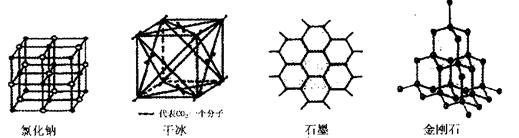
 A.氯化钠的晶体结构中,和钠离子最近且等距离的氯离子组成了一个正八面体
A.氯化钠的晶体结构中,和钠离子最近且等距离的氯离子组成了一个正八面体
B.干冰晶体是CO2分子通过范德华力结合形成的
C.石墨晶体中碳原子数与所形成的共从键数目之比为2:3
D.金刚石晶体是由五个碳原子形成的正四面体分子构成的
28.(12分)X、Y、Z是阳离子,K是阴离子,M、N是中性分子。它们都由短周期组成,且具有以下结构特征和性质:
①它们核外电子总数都相同; ②N溶于M中,滴入酚酞,溶液变红;
③Y和K都由A、B两元素组成,Y核内质子总数比K多两个;
④X和N都由A、C两元素组成,X和Y核内质子总数相等;
⑤X和K的浓溶液在加热情况下生成M和N;
 ⑥Z为单核离子,向含有Z的溶液中加入少量K溶液,有白色沉淀生成,再加入过量的K或Y的溶液,沉淀消失。试完成下列各题:
⑥Z为单核离子,向含有Z的溶液中加入少量K溶液,有白色沉淀生成,再加入过量的K或Y的溶液,沉淀消失。试完成下列各题:
(1)Y的化学式为 ;X的电子式为 ;
(2)试比较M和N的稳定性:M N;
 (3)写出Z和N的水溶液反应的离子方程式 ;
(3)写出Z和N的水溶液反应的离子方程式 ;
(4)上述六种微粒中的两种可与硫酸根形成一种复
盐,向该盐的浓溶液中逐滴加入0.1 mol/L的NaOH
溶液,出现了如右图中a、b、c三个阶段的图象,
根据图象判断该盐的化学式为 。
(5)将1.92 g铜投入到一定量由A、B、C三种元素形成的一种常见化合物的溶液中,共收集到672 mL气体(标准状况下),将盛有此气体的容器倒扣在水槽中,通入一定量的氧气,恰好使气体完全溶于水,则通入氧气在标准状况下的体积是 mL。
27.(15分)已知周期表中,元素Q、R、W、Y与元素X相邻。Y的最高化合价氧化物的水化物是强酸。回答下列问题:
(1)W与Q可以形成一种高温结构陶瓷材料。W的氯化物分子呈正四面体结构,W的氧化物的晶体类型是_________________;
(2)Q的具有相同化合价且可以相互转变的氧化物是___________;
(3)R和Y形成的二价化合物中,R呈现最高化合价的化合物是化学式是___________;
(4)这5个元素的氢化物分子中,①立体结构类型相同的氢化物的沸点从高到低排列次序是(填化学式)___________________,其原因是___________________
②电子总数相同的氢化物的化学式和立体结构分别是____________________________________________;
(5)W和Q所形成的结构陶瓷材料的一种合成方法如下:W的氯化物与Q的氢化物加热反应,生成化合物W(QH2)4和HCl气体;W(QH2)4在高温下分解生成Q的氢化物和该陶瓷材料。上述相关反应的化学方程式(各物质用化学式表示)是____________________________
13.有关晶体的下列说法中正确的是( )
A.分子晶体中分子间作用力越本,分子越稳定
B.离子晶体中肯定不含非极性共价键
C.离子晶体在熔化时,离子键被破坏,而分子晶体熔化时,化学键被破坏
D.两种元素组成的分子晶体中一定只有极性共价键
选择题答题表:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com