
题目列表(包括答案和解析)
13.金属镁在CO2中燃烧生成MgO和C。将一定量金属镁在含CO2、O2的混合气体中燃烧,
然后往所得到的固体中加入足量盐酸,充分反应后,将混合物加热蒸干,隔绝空气灼烧,最终得到的固体成分可能是
A.MgO和C B. MgO
C.MgCl2和C D. Mg(OH)2
12.为了检验某含有NaHCO3杂质的Na2CO3样品的纯度,现将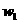 克样品加热,其质量变为
克样品加热,其质量变为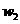 g,,则该样品的纯度(质量分数)是
g,,则该样品的纯度(质量分数)是
A.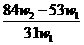 B.
B.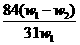 C.
C.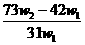 D.
D.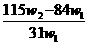
11.下列溶液中,各组离子一定能够大量共存的是
A.使pH试纸变红的溶液:NH4+、Fe3+、SO42-、SCN-
B.加入铝粉生成H2的溶液:K+、Mg2+、SO42-、NO3-
C.澄清透明的无色溶液:NH4+、Al3+、SO42-、CO32-
D.硝酸铁溶液:Na+、Fe2+、Cl-、SO42-
10.下列反应的离子方程式正确的是
A.氢氧化钡溶液与硫酸溶液混合:Ba2++OH-+ H++SO42- === BaSO4↓+H2O
B.氯化铝溶液中加入过量的氨水Al3++4NH3·H2O=AlO2-+4NH4++2H2O
C.溴化亚铁溶液中通入过量的氯气:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-
D.澄清石灰水中加入足量小苏打溶液:Ca2++2OH-+2HCO3- CaCO3↓+
CO32-+2H2O
CaCO3↓+
CO32-+2H2O
9.用NA代表阿伏加德罗常数的值,下列叙述正确的是
A.10mL质量分数为98%的H2SO4,用水稀释至100mL,H2SO4的质量分数为9.8%
B.在H2O2+Cl2=2HCl+O2反应中,每生成32g氧气,则转移2NA个电子确良
C.5.6g铁粉在2.24L(标准状态)氯气中充分燃烧,失去的电子数为0.3NA
D.标准状况下,11.2 L的SO3所含分子数为0.5NA
8.25℃时,某物质(无结晶水)溶解度为S g,其摩尔质量为M g/mol,饱和溶液密度为
d g/cm3。则其饱和溶液的物质的量浓度为
A.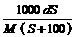 mol/L
B.
mol/L
B.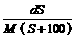 mol/L
mol/L
C.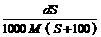 mol/L
D.
mol/L
D.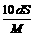 mol/L
mol/L
7.某强酸性溶液中可能存在NO3-、I-、Cl-、Fe3+中的一种或几种。向该溶液中加入溴水后,Br2被还原,由此推断该溶液中
A.不含NO3-,含Fe3+ B.含I-,不含NO3-、Fe3+,但不能确定是否含Cl-
C.含有NO3-、I-、Cl- D.一定含有Cl-
5.下列反应中,改变反应条件或反应物浓度后,反应产物不会改变的是
A.钠与氧气 B.硫酸与铝片
C.盐酸与铁粉 D.二氧化硫与氨水
学6.下列说法正确的是
A.发酵粉中含有烧碱,能使焙制的糕点疏松
B.阳离子只有氧化性,阴离子只有还原性
C.Na2O和Na2O2固体中阳离子和阴离子个数比相等
D.明矾属于盐类,其水溶液显中性
25.(10分)氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:
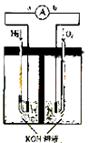 (1)负极反应式为 。
(1)负极反应式为 。
(2)电极表面镀铂粉的原因为 。
(3)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
Ⅰ.2Li+H2
 2LIH
2LIH
Ⅱ.LiH+H2O==LiOH+H2↑
①反应Ⅰ中的还原剂是 ,反应Ⅱ中的氧化剂是 。
②已知用锂吸收224L(标准状况)H2,生成的LiH与H2O作用,放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为 mol。
24.(10分)实验室有一包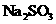 样品,可能含有
样品,可能含有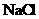 、
、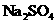 、
、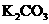 、
、 中
中
的一种或几种物质,为确定样品中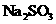 的质量分数和该样品的成分,进行如下实验:
的质量分数和该样品的成分,进行如下实验:
称取此样品6.30g,加入 的硫酸至过量,产生无色气体
的硫酸至过量,产生无色气体 (标准状况)。
(标准状况)。
向逸出气体后的溶液中加入稍过量的 溶液,得到白色沉淀
溶液,得到白色沉淀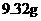 ,透过蓝色钴玻
,透过蓝色钴玻
璃观察,滤液的焰色反应无紫色。
请回答下列问题:
(1)若用下图所示仪器组装进行上述实验,正确的连接顺序是(填序号)__________;
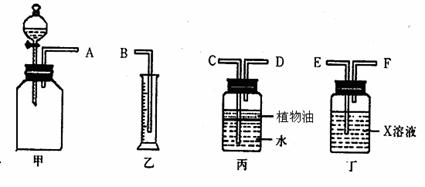
A.A→C→D→F→E→B B.A→D→C→E→F→B
C.A→F→E→C→D→B D.A→E→F→D→C→B
(2)丁装置中X溶液是__________;丙装置中植物油的作用是___________________;
(3)样品中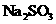 的质量分数为______________;
的质量分数为______________;
(4)若上述实验中加入硫酸溶液的体积为 ,则该样品中一定还含有的物质是
,则该样品中一定还含有的物质是
_______________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com