
题目列表(包括答案和解析)
3.[盐城市伍佑中学2009年江苏高考化学押题卷](A)[物质结构与性质]等电子体原理是指两个或两个以上的分子(或离子),它们的原子数相同,分子(或离子)中价电子数也相同,这些分子(或离子)常具有相似的电子结构,相似的几何构型,而且有时在性质上也有许多相似之处。
(1)SiO32-、SO32-、NO3-三种离子是等电子体,三种离子的几何构型为__________,其中Si、S、N三种基态原子的第一电离能大小关系为_____________________。
(2)C2O42-和 是等电子体,C2O42-离子具有较强的还原性,它能使酸性KMnO4溶液褪色,Mn原子在元素同期表中的位置是__________,外围电子构型为__________。
(3)二原子14电子的等电子体共同特点是物质中都具有共价叁键,请举出相应的3个例子____________________(可以是分子或离子)。每个分子或离子中含_____个σ键,______个π键。
(4)过去生产上常以SiO2为催化剂的载体,它和近十几年来应用日广的AlPO4是等电子体,在AlPO4中 P为 配位氧。SiO2的晶胞可作如下推导:先将NaCl晶胞中的所有Cl-去掉,并将Na+全部换成Si原子,再在每两个不共面的“小立方体”中心处各放置一个Si原子便构成了晶体Si的一个晶胞,则一个硅的晶胞中有________个Si原子。再在每两个相邻的Si原子(距离最近的两个Si原子)中心联线的中点处增添一个O原子,便构成了SiO2晶胞,故SiO2晶胞中有_______个Si原子,______个O原子。
1.[南京市2009届高三第一次调研测试]下表是元素周期表的一部分。表中所列的字母分别代表某一种化学元素。
|
Z |
|
|
|
|
|||||||||||||
|
|
|
M |
L |
Q |
R |
|
|
||||||||||
|
D |
A |
|
|
T |
X |
Y |
|
||||||||||
|
E |
|
|
|
|
|
|
|
|
J |
|
|
|
|
|
|
|
|
(1)Y分别与D、E形成的化合物中熔点较高是 ▲ (用化学式表示);T、X、Y原子的第一电离能由小到大的顺序是 ▲ (用元素符号表示)。
(2)LX2分子的电子式是 ▲ ,XY2分子是 ▲ (填“极性分子”或“非极性分子”);QY3分子中Q采用 ▲ 杂化。
(3)由J、L、R三种元素形成的某种配位化合物,该化合物具有挥发性,化学式为J(LR)4,其中J的化合价是0价。则J原子的核外电子排布式是 ▲ (基态);与配体粒子互为等电子体的离子是 ▲ ;J(LR)4固态时属于 ▲ 晶体(填晶体类型)
(4)由Z、L、Q三种元素组成的化合物,分子式为Z9L3Q,它有多同分异构体(其中Q以三个单键与其它原子相连),写出其中沸点最低的物质结构简式 ▲ 。
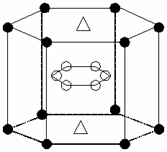
(5)A与M组成的一种化AM2,刷新了金属化合物超导 温度的最高记录。右图中所示的是该化合物的晶体结构单元。图中上下底面中心“Δ”处的原子是 ▲ (填元素符号)。

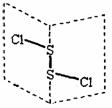 2.[盐城市伍佑中学2009年江苏高考化学押题卷]二氧化碳硫(S2Cl2)是广泛用于橡胶工业的硫化剂;其分子结构如右下图所示。常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体。下列说法中错误的是[B]
2.[盐城市伍佑中学2009年江苏高考化学押题卷]二氧化碳硫(S2Cl2)是广泛用于橡胶工业的硫化剂;其分子结构如右下图所示。常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体。下列说法中错误的是[B]
A.S2Cl2的电子式为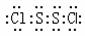
B.S2Cl2为含有极性键和非极性键的非极性分子
C.S2Br2与S2Cl2结构相似,熔沸点:S2Br2>S2Cl2
D.S2Cl2与H2O反应的化学方程式可能为:
2S2Cl2+2H2O=SO2↑+3S↓+4HCl
21.(6分)取一定量的Na2CO3、NaHCO3和Na2SO4混合物与250mL 1.00mol·L-1过量盐酸
反应,生成2.016L CO2(标准状况),然后加入500mL 0.100mol·L-1Ba(OH)2溶液,得到
沉淀的质量为2.33g,溶液中过量的碱用10.0mL 1.00ml·L-1盐酸恰好完全中和。
计算混合物中各物质的物质的量。

20.(12分)某化学研究性学习小组对某工厂生产印刷电路板后所得废液进行探究
(生产原理:2Fe3+
+ Cu  2Fe2+ + Cu2+)。请按要求完成下列探究报告。
2Fe2+ + Cu2+)。请按要求完成下列探究报告。
[探究目的]
从废液中回收铜,并重新得到FeCl3溶液。
[资料获悉]
①3Fe2+ + NO3- + 4H+  3Fe3+ + NO↑ + 2H2O
3Fe3+ + NO↑ + 2H2O
②有关金属离子从开始沉淀到沉淀完全时溶液的pH:
Fe3+:2.7-3.7 Cu2+:5.2-6.4 Fe2+:7.6-9.6
[探究思路]
(1)先确定废液的组成及各金属离子的浓度;
(2)选择合适试剂回收铜,并重新得到FeC13溶液。
[实验探究]
取几滴废液于试管中,加水稀释后,滴加KSCN溶液,出现血红色,可知废液中除含有Fe2+、Cu2+外,还含有Fe3+。
甲同学取10 mL废液,向其中加入足量的AgNO3溶液,得到的沉淀经过滤、洗涤、干燥,称重8.61g。乙同学另取10 mL废液,加入某试剂将pH调至4.0,使其中Fe3+转化为Fe(OH)3沉淀,而Fe2+、Cu2+仍留在废液中,沉淀经过滤、洗涤、灼烧,冷却后称重得0.32 g。
通过计算可知废液中。c(Fe3+)=_____________mol/L,c(Fe2+)=____________mol/L,c(Cu2+)=__________________mol/L。
[交流讨论]
如何回收1L废液中含有的铜,并重新得到FeC13溶液?
丙同学认为应该先向废液中加入wg铁粉[w=c(Cu2+)×1 L × 56 g/mol],使之充分反应置换出铜,过滤,得金属铜。再向滤液中加入适量的稀硝酸,将Fe2+全部氧化为Fe3+,并进行尾气处理,即可达到实验目的。有些同学认为丙同学的方案不可行,请你评价丙同学的方案有哪些不妥之处?(不一定填满)
(1)_______________ (2)____________ (3)____________
该小组同学根据讨论得到的合理方案进行操作,最终达到了预期目的。(方案内容略)
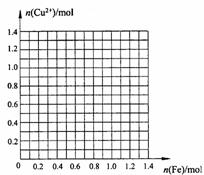 [拓展延伸]
[拓展延伸]
请画出1L废液中加入铁粉的物质的量与废液中铜离子
的物质的量的关系曲线,并利用图像计算,当铜离子的
物质的量减少一半时,加入铁粉的质量是______ _g。
19.(12分)实验室需用0.2000 mol·L-1 的Na2CO3溶液480 mL,现在请你用碳酸钠晶体(Na2CO3·10H2O)配制,可供选择的仪器有:①玻璃棒 ②烧瓶 ③烧杯 ④胶头滴管 ⑤量筒 ⑥托盘天平 ⑦药匙⑧容量瓶。请回答下列问题:
(1)上述仪器中,在配制Na2CO3溶液时不需要使用的有 (填代号);
(2) 容量瓶上标有 、 、 ;
(3)经计算,本实验需称量碳酸钠晶体(Na2CO3•10H2O) g。
(4)某同学将称量好的碳酸钠晶体用适量的蒸馏水在烧杯中溶解,直接倒进所选的且经过
检查不漏水的容量瓶中,洗涤烧杯和玻璃棒2-3次,洗涤液也转移至容量瓶中,然后直接加蒸馏水至刻度线,将容量瓶倒转摇匀。请指出上述操作中的至少两处错误:
①
②
(5)请你分析下列哪些操作会引起所配浓度偏大(填写字母) 。
A.用托盘天平称量时,砝码生锈;
B.容量瓶未干燥即用来配制溶液;
C.往容量瓶中转移溶液时,有少量液体溅出;
D.溶解碳酸钠晶体的烧杯未进行洗涤;
E.在容量瓶中定容时俯视容量瓶刻度线;
F.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线。
18.(12分)某课外兴趣小组为探究某种铝合金(合金元素为Mg、Al)是否符合国家质量标准(国家规定其中铝含量不能低于78%),设计右图装置进行实验。
 (1)如何检验该装置的气密性____________________。
(1)如何检验该装置的气密性____________________。
如何将叉形管中固体M和NaOH溶液混合反应:
。
(2)使氢氧化钠溶液(足量)与ag合金粉末(固体M)
充分反应,待反应停止后,进入量气管气体的体积
为V mL(已折算成标准状况)。若量气管最大量程
为50mL,则固体M中铝的质量m(Al)范围为:
_________ 。
记录最终量气管中水面高度时,除视线平视外,还应 。
(3)若将装置中的NaOH溶液替换为足量的盐酸,则反应停止后量气管内气体体积____
(填“>”、“<”、“=”) VmL。
(4)若a =38mg,V=44.8mL(标准状况),请通过计算说明该合金是否符合国家标准
(不写计算过程) 。(填“符合”、 或“不符合”)
17.(10分)已知将盐酸滴入高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红色褪去。现有一个氧化还原反应的体系中,共有KCl、Cl2、H2SO4、H2O、KMnO4、MnSO4、K2SO4七种物质:
⑴该反应中,化合价升高的反应物是 ;化合价没有发生变化的反应物是 。
⑵写出一个包含上述七种物质的氧化还原反应方程式(需配平)
。
⑶上述反应中,被氧化的元素是 ;氧化剂是 ,1mol氧化剂在反应中 (填“得到”或“失去”) mol电子。
⑷在反应后的溶液中加入无色NaBiO3溶液,又会变成紫红色。说出NaBiO3的一个性质:
。
16.(10分)下图表示各物质之间的相互转化关系。已知A、D、F、H均为单质,X常温下为无色液体,B为淡黄色固体,J溶于酸得到黄色溶液。
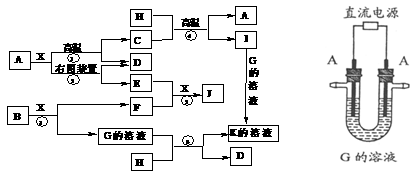
请按要求填空:
⑴写出B的电子式:____________________。
⑵反应⑤的化学反应方程式是_____________________________________________。
⑶反应①的化学反应方程式是 ,
在实验室引发反应④的操作是 。
⑷反应⑥的离子方程式是__________________________ _______________。
15.(10分) 有一包白色固体混合物,可能含有的阴、阳离子分别是:
|
阳离子 |
K+ Na+ Ag+ NH4+ Mg2+ Ba2+ |
|
阴离子 |
SO42 – SO32- CO32- AlO2- MnO4- |
为了鉴定其中的离子,现进行以下实验:
(1)取该粉末,加水后得到无色透明溶液,且未嗅到气味;用pH试纸测得溶液的pH为12。
则排除的离子是 。
(2)向溶液中滴加盐酸,开始有沉淀生成,继续滴加沉淀消失,同时有无色无味气体逸出。
则肯定存在的离子是 ,排除的离子是 。
(3)尚待检验的离子是 ,检验方法是 。
14.Mg2+和Al3+的混和溶液中逐滴加入NaOH溶液,形成沉淀的情况出现两种图示。图1为小杨同学绘制,图2是小周根据实验结果绘制,查阅沉淀生成和Al(OH)3溶解的pH情况如表。下列说法正确的是

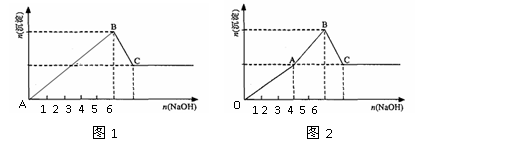
A.据图计算得n(Mg2+): n(Al3+)=2:1
B.小周实验中,OA段生成两种沉淀
C.图2中OA段表示仅生成Al(OH)3沉淀,AB段仅生成 Mg(OH)2
D.结合表中数据和图2分析,AB段可能发生:Al(OH)3+OH-=AlO2-+2H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com