
题目列表(包括答案和解析)
9.下列说法中正确的是
A.次外层电子数是2或8或18的原子一定是主族元素
B.HCl气体溶于水共价键被破坏
C.砹(At)是第VIIA族,其氢化物的稳定大于HC1
D.核外电子排布相同的微粒,一定具有相同的化学性质
8.下列关于盐酸与醋酸两种稀溶液的说法正确的是
A.相同浓度的两种溶液中c(H+)相同
B.100mL 0.1mol/L 的两种溶液中和等物质的量的氢氧化钠
C.pH=3 的两种溶液稀释100倍,pH都为5
D.两溶液中分别加入少量对应的钠盐,c(H+)均明显减小
7.用NA表示阿伏加德罗常数的值,下列说法中正确的是
A.常温常压下,0.2mol铁在0.2mol氯气中充分燃烧,转移的电子数为0.6NA
B.标准状况下,2.24L的苯中含有0.3NA个碳碳双键
C.工业用电解法进行粗铜精炼时,每转移1mol电子,阳极上溶解的铜原子数必为0.5NA
D.VL amoL/L的氯化铁溶液中,若Fe3+的数目为NA,则C1-的数目小于3NA
6.在室温下,一元酸HA的溶液与一元碱BOH的溶液等体积混合,下列有关判断正确的是
A.若混合后所得溶液呈中性,则HA肯定是强酸、BOH肯定是强碱
B.若混合前酸,碱pH之和等于14,混合后所得溶液呈碱性,则HA肯定是弱碱
C.若混合前酸,碱物质的量浓度相同,混合后所得溶液呈酸性,则HA肯定是弱酸
D.若混合后所得溶液呈酸性,则混合溶液中离子浓度一定满足:
c(B+)>c(A-)>c(H+)>c(OH-)
5. X、Y、Z和R为原子序数依次递增的四种元素。其中X、Y同周期,X的最高正价是最低负价绝对值的3倍,Y、Z、R同主族,R为人体所需的微量元素。下列说法不正确的是
A.127R-的核外含有54个电子
B.Y、Z、R的氢化物的稳定性逐渐减弱
C.有1mol Y的单质与水发生反应则转移电子的物质的量为2mol
D.在含有Z单质的水溶液中,通入足量XO2气体,则溶液由黄色变为无色
4. 2007年10月10日,德国科学家格哈德·埃尔特生日的当天获得了诺贝尔化学奖,以奖励他在表面化学领域做出开拓性的贡献。合成氨反应在铁催化剂表面进行时效率显著提高,就是埃尔特的研究成果,下列关于合成氨反应的叙述中正确的是
A.铁做催化剂可加快反应速率,且有利于平衡向合成氨的方向移动
B.将氨从混合气中分离,可加快反应速率,且有利于平衡向合成氨的方向移动
C.升高温度可以加快反应速率,且有利于平衡向合成氨的方向移动
D.增大压强可加快反应速率,且有利于平衡向合成氨的方向移动
3.下列物质为固态时,必定是分子晶体的是
A.酸性氧化物 B.非金属单质 C.碱性氧化物 D.含氧酸
2.下列实验能达到预期目的的是
A.通过电泳实验证明胶体带电
B.通常利用丁达尔效应区别溶液与胶体
C.渗析实验说明胶体粒子能透过半透膜
D.向煮沸的NaOH溶液中滴加FeCl3溶液可制备Fe(OH)3胶体
1.下列分子中所有原子均满足最外层8电子结构的是
A.LiCl B.NCl3 C.PCl5 D.BF3
1.[南京市2009届高三化学考前专题]四种常见元素的性质或结构信息如下表,试根据信息回答有关问题。
|
元素 |
A |
B |
C |
D |
|
性质 结构 信息 |
原子核外有两个电子层,最外层有3个未成对的电子 |
原子的M层有1对成对的p电子 |
原子核外电子排布为[Ar]3d104sx, 有+1、+2两种常见化合价 |
有两种常见氧化物,其中有一种是冶金工业常用的还原剂 |
⑴写出B原子的电子排布式 ▲ 。
⑵A元素的氢化物的沸点比同主族相邻元素氢化物沸点 ▲ (填“高”或“低”),其原因是 ▲ 。
⑶D元素最高价氧化物的熔点比同主族相邻元素最高价氧化物的熔点 ▲ (填“高”或“低”),其原因是 ▲ 。
⑷往C元素的硫酸盐溶液中逐滴加入过量A元素的氢化物水溶液,可生成的配合物的化学式为 ▲ ,简要描述该配合物中化学键的成键情况 ▲ 。
 ⑸下列分子结构图中的“
”表示上述相关元素的原子中除去最外层电子的剩余部分,
⑸下列分子结构图中的“
”表示上述相关元素的原子中除去最外层电子的剩余部分,
“ ”表示氢原子,小黑点“ ”表示没有形成共价键的最外层电子,短线表示共价键。
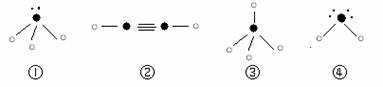
则在以上分子中,中心原子采用sp3杂化形成化学键的是 ▲ (填写序号);在②的分子中有 ▲ 个σ键和 ▲ 个π键。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com