
题目列表(包括答案和解析)
28. 乙酸乙酯是重要的工业原料和溶剂,通常混有少许乙醇和乙酸。某学习小组利用图1装置制取乙酸乙酯粗产品,再分析乙酸乙酯的含量。
|
|
乙酸乙酯 |
乙醇 |
乙酸 |
|
沸点 |
77.1℃ |
78.5℃ |
117.9℃ |
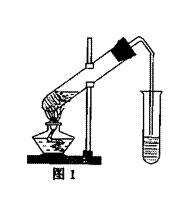
操作步骤如下:
 (I)准确称量20.0g乙酸乙酯粗品于锥形瓶中,用0.50mol·L-1NaOH滴定(酚酞做指示剂)。终点时消耗NaOH溶液的体积为40.0mL
(I)准确称量20.0g乙酸乙酯粗品于锥形瓶中,用0.50mol·L-1NaOH滴定(酚酞做指示剂)。终点时消耗NaOH溶液的体积为40.0mL
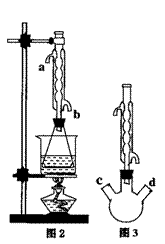
(II)另取20.0g乙酸乙酯粗产品于250mL锥形瓶中,加入100mL 2.1mol·L-1NaOH溶液混合均匀后,装上冷凝箱,在水浴上加热回流约1小时,装置如图2所示。待冷却后,用0.50mol·L-1HCl滴定过量的NaOH。终点时消耗盐酸的体积为20.0mL。
回答下列问题:
(1)实验(II)中冷水从冷水凝管的 (填a或b)
管口通入。
(2)利用实验(I)、(II)测量的数据计算粗产物中乙酸
乙酯的质量分数为 。
(3)实验结束后,同学们对粗产品中乙酸乙酯的含量不高进行讨论。
①有人认为是实验(II)带来的误差。建议将图2中的锥形瓶改为三颈瓶,装置如图3,在三颈瓶的c、d口装配相关的仪器并进行恰当的操作,可以提高测定的精确度。你认为在三颈瓶的c、d口装配相关的仪器或操作是: (填字母);
A.装上温度计,严格控制反应温度
B.实验中经常打开瓶口,用玻璃棒进行搅拌
C.在反应后期,用事先安装的分液漏斗添加一定量的NaOH溶液
②还有同学认为改进乙酸乙酯的制取装置(图1)才能提高产率。拟出你的一条改进建议 ______________________________________________。
27. 2001年是20世纪伟大的化学家鲍林(Linus Pauling 1901~1994)诞辰100周年纪念。他是一位化学结构大师,因对化学键的本性及其对复杂物质结构的解释而获得1954年度的诺贝尔化学奖。1994年这位世纪老人谢世,人们打开他的办公室,发现里面有一块黑板,画得满满的,其中有一结构式如图所示。老人为什么画这个结构式?它在自然界存在吗?它是炸药吗?它能合成吗?它有什么性质?……不得而知。这是鲍林留给世人的一个谜。也许有朝一日能解开它。
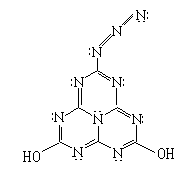 请你对这个结构作一番分析后,回答下列问题。
请你对这个结构作一番分析后,回答下列问题。
⑴它的分子式是 。
⑵如果该分子中的氮原子都在一个平面上,那么该分子中的所有原子是否可能处于同一平面内__________(填“可能”或“不可能”)。
⑶该分子的侧链相当于叠氮酸根,它类似于一种叫叠氮酸铅的雷管起爆剂,因此有人预测它是炸药,如果它在没有氧气参与的情况下爆炸,反应的化学方程式(发生分解反应,生成两种单质和两种化合物)是______________________________________________;如果有足量氧气参与的条件下发生爆炸,那么,1mol该化合物爆炸时需消耗 mol氧气。
26. 环己烯可以通过丁二烯与乙烯发生环化加成反应得到(方程式中有机物用键线式表示,例如“||”表示CH2=CH2, 表示CH2=CH-CH=CH2):
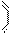
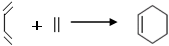
实验证明,下列反应中反应物分子的环外双键比环内双键更容易被氧化:
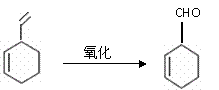
现仅以丁二烯为有机原料,无机试剂任选,按下列途径合成甲基环已烷:


请按要求填空:
(1)A的结构简式是 ;B的结构简式是 ;
(2)写出下列反应的化学方程式和反应类型:
反应④ ,反应类型 ;反应⑤ ,反应类型 。
25. NaNO2大量用于染料工业和有机合成工业中,然而由于NaNO2有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下:
___NaNO2+___KI+___ ______→___NO+___I2+___K2SO4+___Na2SO4+___ ______
(1) 请完成该化学方程式并配平。
(2) 在上述反应中,若要生成25.4克I2,则电子转移了__________个。
(3) 上述反应中,氧化产物是________。
A. NO B. I2 C. K2SO4 D. Na2SO4
24. U、V、W、X、Y、Z是原子序数依次增大的六种常见元素。Y的单质在W2中燃烧的产物可使品红溶液褪色。Z和W元素形成的化合物Z3W4具有磁性。U的单质在W2中燃烧可生成UW和UW2两种气体。X的单质是一种金属,该金属在UW2中剧烈燃烧生成黑、白两种固体。
请回答下列问题:
⑴V的单质分子的结构式为_______________;XW的电子式为____________;
写出X元素原子的电子排布式___________________________________________。
写出Y原子核外电子的轨道式__________________________________________。
⑵U元素形成的同素异形体的晶体类型可能是(填序号)__________。
① 原子晶体 ② 离子晶体 ③ 分子晶体 ④ 金属晶体
⑶.U、V、W形成的10电子氢化物中,U、V的氢化物沸点较低的是(写化学式)__________;V、W的氢化物分子结合H+能力较强的是(写化学式)______________,用一个离子方程式加以证明____________________________________________________。
⑷.YW2气体通人BaCl2和HNO3的混合溶液,生成白色沉淀和无色气体VW,有关反应的离子方程式为__________________________________________,由此可知VW和YW2还原性较强的是(写化学式)______________________________。
23. (1) 有下列操作:
①用玻璃棒蘸取待测液少许沾在湿润的pH试纸上,测定溶液的pH
②用稀硝酸洗涤做银镜反应时附着在试管壁上的银
③溴乙烷试样加入稀氢氧化钠溶液煮沸,然后再加入硝酸银溶液检验其中含有溴元素
④在测定结晶水时,将灼烧硫酸铜晶体的坩埚放在空气中冷却,然后称量其质量
⑤在某试样中加入盐酸酸化的氯化钡溶液有白色沉淀,可推论试样中肯定有SO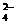
⑥实验室配制氯化亚铁溶液时,将氯化亚铁先溶解在盐酸中,再用蒸馏水稀释并放入少量铁粉
其中设计和推理均合理的是____________(填序号,多选扣分)
(2)今有化合物

①请写出丙中含氧官能团的名称:_____________________________________
②请分别写出鉴别甲、乙、丙化合物的方法(指明所选试剂及主要现象即可)。
鉴别甲的方法:_____________________________________________
鉴别乙的方法:_____________________________________________
鉴别丙的方法:_____________________________________________
③请按酸性由强至弱排列甲、乙、丙的顺序:_________________________
22. 向300mLKOH溶液中缓慢通入2.24L(标准状况) CO2气体,充分反应后,在减压低温下蒸发溶液,得到19.4g白色固体.则下列说法中正确的是
A. 此白色固体是KOH和K2CO3的混合物
B. 此白色固体是K2CO3和KHCO3的混合物
C. 原KOH溶液的物质的量浓度是1 mol/L
D.原KOH溶液的物质的量浓度是0.5 mol/L
II 非选择题
21. “酸碱质子理论”认为凡是能够给出质子(H+)的分子或离子都是酸,凡是能够接受质子的分子或离子都是碱,物质酸性(碱性)的强弱取决于分子或离子给出(接受)质子能力的大小。按照“酸碱质子理论”,下列说法正确的是
A.HCO3- 既是酸又是碱,NH3既不是酸又不是碱
B.ClO-+H2O HClO+OH-是酸碱反应
HClO+OH-是酸碱反应
C.2Na+2H2O→2NaOH+H2↑是酸碱反应
D.碱性强弱顺序为:C2H5O- > OH- > C6H5O-
20. 设阿伏加德罗常数为NA,则下列说法正确的是
A.常温常压下,11.2L甲烷中含有的氢原子数小于2NA
B.标准状况下,22.4L三氧化硫中含有氧原子数为0.3NA
C.常温下,2.7g铝与足量的盐酸反应,失去电子数为0.3NA
D.常温下,1L0.1mol/LMgCl2溶液中含Mg2+数为0.2NA
19. 下列说法正确的是
A. 0.1mol/L的NaOH溶液200mL中,通入448mL(标准状况)H2S气体,所得溶液离子浓度大小关系为:[Na+]>[HS-]>[OH-]>[H2S]>[S2-]>[H+]
B. 等物质的量浓度的Na2CO3和NaHCO3的混合溶液中:
2[Na+]=3×([CO32-]+[HCO3-]+[H2CO3])
C. pH=8的NaHCO3溶液中,[H2CO3]-[CO32-]=10-8
D. t℃时,将pH=2的HCl和pH=4的HCl溶液等体积混合,所得溶液pH约为2.3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com