
题目列表(包括答案和解析)
8.欲验证某瓶中装的是氨水,现用一沾有浓盐酸的玻璃棒靠近瓶口,为了使现象明显,可先往瓶中加入一种物质,该物质可以选用下列物质中的 ( )
①浓H2SO4 ②固体烧碱 ③固体碳酸钙
④生石灰 ⑤固体NH4Cl ⑥固体食盐
A.①② B.②③④ C.②④⑤ D.①③⑥
7.下列有关铝及其化合物的叙述正确的是 ( )
A.铝粉与氧化镁共热可制取金属镁
B.足量铝分别与含1molHCl、1molNaOH的溶液反应,产生相同量的氢气
C.工业上用电解熔融Al2O3的方法冶炼铝
D.在浓硝酸中加入等体积的浓硫酸后,立即加入铝片,铝片表面发生钝化
6.将①氢气;②氧气;③甲烷三种气体分别盛放在三个容器中,并保持三个容器内气体的温度和密度均相等,这三种气体对容器所施加压强的大小关系是 ( )
A.①>②=③ B.①<②<③
C.①>③>② D.①<③<②
5.普通水和重水(D2O)的质量比为何值时,二者所含中子数相等 ( )
A.10:9 B.9:8 C.8:9 D.5:4
4.主族元素的次外层电子数(除氢) ( )
A.一定是8个 B.一定是2个 C.一定是18个 D.是2个、8个或18个
3.影响一定量气体占有体积大小的主要因素是 ( )
A.气体分子的微粒数 B.微粒本身的大小
C.微粒的质量 D.微粒间的平均距离
2.已知碳有两种常见的同位素12C和13C,氧有三种常见的同位素18O、17O、16O,由这五种微粒构成的CO2分子中,相对分子质量最多可能有 ( )
A.6种 B.10种 C.11种 D.12种
1.2007年3月21日,我国公布了111号元素Rg的中文名称。该元素名称及所在周期为( )
|
C.钅 第七周期 D.氡 第六周期
21.(10分)计算
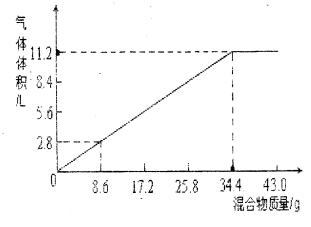 在100mLNaOH溶液中加入
在100mLNaOH溶液中加入 和
和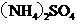 的固体混合物,加热充分反应,下图表示加入的混合物质量与产生的气体体积(标准状况)的关系(假设气体全部逸出)。试计算(写出必要的计算过程):
的固体混合物,加热充分反应,下图表示加入的混合物质量与产生的气体体积(标准状况)的关系(假设气体全部逸出)。试计算(写出必要的计算过程):
(1)Na0H的物质的量浓度是多少?
(2)当Na0H溶液的体积为140mL,
固体混合物的质量是51.6g时,
充分反应后,生成气体的体积
(标准状况)为多少? 

(3)当Na0H溶液的体积为180mL,
固体混合物的质量仍为51.6g时,
充分反应后,生成气体的体积
(标准状况)为多少?

20.(12分)元素×、Y、Z、W均为短周期元素,且原子序数依次增大。已知Y原子最外层电子数占核外电子总数的3/4,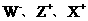 半径逐渐减小,化合物XW常温下为气体,Z是本周期中除稀有气体元素外,原子半径最大的元素,据此回答下列问题:
半径逐渐减小,化合物XW常温下为气体,Z是本周期中除稀有气体元素外,原子半径最大的元素,据此回答下列问题:
(1)W在元素周期表中的位置: ,工业上生产W单质的离子方程式为:
。
(2)A、B均为由上述四种元素中的三种组成的强电解质,且常温下两种物质的水溶液pH均大于7,组成元素的原子数目比均为1:1:1。若A能抑制水的电离,而B能促进水的电离,则A、B的化学式分别为 、
(3)C是由上述四种元素的两种组成的一种含有非极性键的离子化合物,则C的电子式
为 。
(4)用B在碱性条件下可以处理含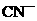 的工业废水,请将下列6种微粒:
的工业废水,请将下列6种微粒: 

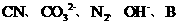 的阴离子,W的阴离子,分别填入在下对应的横线上,组成一个配平的离子方程式:
+ + - + +
的阴离子,W的阴离子,分别填入在下对应的横线上,组成一个配平的离子方程式:
+ + - + +
+ 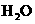
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com