
题目列表(包括答案和解析)
1.1999年1月,俄美科学家联合小组宣布合成出114号元素的一种同位素,该同位素原子的质量数为298。以下叙述不正确的是 k+s-5#u ( )
A.该元素属于第七周期 k+s-5#u B.该元素位于III A族
C.该元素为金属元素,性质与82Pb相似
D.该同位素原子含有114个电子和184个中子k+s-5#u
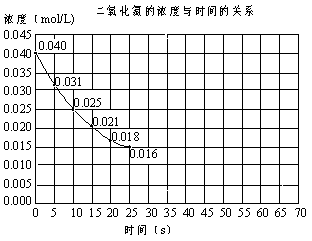
22.(共8分)二氧化氮在加热条件下能够分解成一氧化氮和氧气。该反应进行
到45秒时,达到平衡(NO2浓度约为0.0125mol/L)。下图中的曲线表示二氧化
氮分解反应在前25秒内的反应进程。 (1)请计算前20秒内氧气的平均生成速度: (2)若反应延续至70秒,请在图中用实线画出25秒至70秒的反应进程曲线。 (3)若在反应开始时加入催化剂(其他条件都不变),请在图上用虚线画出加
化剂后的反应进程曲线。
21.(共12分)
 (1)对于下列反应:2SO2 + O2
(1)对于下列反应:2SO2 + O2
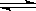 2SO3 ,
如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么,用SO2浓度变化来表示的化学反应速率为___________________,用O2浓度变化来表示的反应速率为____________________。如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L·min),那么2min时SO2的浓度为_____ ______。
2SO3 ,
如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么,用SO2浓度变化来表示的化学反应速率为___________________,用O2浓度变化来表示的反应速率为____________________。如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L·min),那么2min时SO2的浓度为_____ ______。
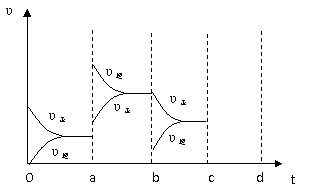 (2)下图左表示在密闭容器中反应:2SO2+O2
(2)下图左表示在密闭容器中反应:2SO2+O2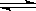 2SO3 △H<0,达到平衡时,
2SO3 △H<0,达到平衡时,
由于条件改变而引起
反应速度和化学平衡
的变化情况,a b过
程中改变的条件可能
是 ;
b c过程中改变的条件
可能是 ; 若增大压强时,反应速度变化情况画在c~d处。
20.(共14分)
(1)对于可逆反应CO(g)+NO2(g) 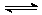 CO2(g)+NO(g) △H<0,在一定条件下达到平衡状态后,若改变条件(未说明的条件不变),对有关物理量及平衡状态有何影响?将变化结果(填增大、减小、不变、变深、变浅,正反应,逆反应),填入空格。
CO2(g)+NO(g) △H<0,在一定条件下达到平衡状态后,若改变条件(未说明的条件不变),对有关物理量及平衡状态有何影响?将变化结果(填增大、减小、不变、变深、变浅,正反应,逆反应),填入空格。
① 压强不变,充入少量氦气,混合气体的颜色 。
② 升高体系的温度,混合气体的平均摩尔质量 。
③ 使用正催化剂, CO的转化率 。
④ 体积不变,缓慢充入少量氧气,平衡向 方向移动。
(2) 反应m A+n
B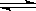 p C在某温度下达到平衡。
p C在某温度下达到平衡。
① 若A、B、C都是气体,减压后正反应速率小于逆反应速率,则m、n、p的关系是
。
② 若C为气体,且m + n = p,在加压时化学平衡发生移动,则平衡必定向
方向移动。
③如果在体系中增加或减少B的量,平衡均不发生移动,则B肯定不能为 态。
19.(共9分)
 (1)已知1g碳粉在氧气中完全燃烧放出的热量是32.8 kJ,试写出相关的热化学方程式:
。
(1)已知1g碳粉在氧气中完全燃烧放出的热量是32.8 kJ,试写出相关的热化学方程式:
。
(2)运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
①合成氨反应N2(g)+3H2(g) 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡 移动(填“向左”、“向右”或“不”);使用催化剂 反应的△H(填“增大”、“减小”或“不改变”)。
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡 移动(填“向左”、“向右”或“不”);使用催化剂 反应的△H(填“增大”、“减小”或“不改变”)。
②已知:O2(g)
 O2+(g)+e-
△H1=+1175.7 kJ·mol-1
O2+(g)+e-
△H1=+1175.7 kJ·mol-1
PtF6(g)+e- PtF6-(g)
△H2=-771.1 kJ·mol-1
PtF6-(g)
△H2=-771.1 kJ·mol-1
O2PtF6(s) O2+(g)+PtF6-(g) △H3=+482.2 kJ·mol-1
O2+(g)+PtF6-(g) △H3=+482.2 kJ·mol-1
则反应O2(g)+PtF6(g)
 O2+PtF6-(s)的 △H=_____________ kJ·mol-1
O2+PtF6-(s)的 △H=_____________ kJ·mol-1
18.(共11分)下表是稀硫酸与某金属反应的实验数据:
|
实验序号 |
金属质量/g |
金属状态 |
C(H2SO4)/mol·L-1 |
V(H2SO4)/mL |
溶液温度/℃ |
金属消失的时间/s |
|
|
反应前 |
反应后 |
||||||
|
1 |
0.10 |
丝 |
0.5 |
50 |
20 |
34 |
500 |
|
2 |
0.10 |
粉末 |
0.5 |
50 |
20 |
35 |
50 |
|
3 |
0.10 |
丝 |
0.7 |
50 |
20 |
36 |
250 |
|
4 |
0.10 |
丝 |
0.8 |
50 |
20 |
35 |
200 |
|
5 |
0.10 |
粉末 |
0.8 |
50 |
20 |
36 |
25 |
|
6 |
0.10 |
丝 |
1.0 |
50 |
20 |
35 |
125 |
|
7 |
0.10 |
丝 |
1.0 |
50 |
35 |
50 |
50 |
|
8 |
0.10 |
丝 |
1.1 |
50 |
20 |
34 |
100 |
|
9 |
0.10 |
丝 |
1.1 |
50 |
20 |
44 |
40 |
分析上述数据,回答下列问题:
(1)实验4和5表明, 对反应速率有影响, 反应速率越快,能表明同一规律的实验还有 (填实验序号);
(2)仅表明反应物浓度对反应速率产生影响的实验有 (填实验序号);
(3)本实验中影响反应速率的其他因素还有 ,其实验序号是 。
(4)实验中的所有反应,反应前后溶液的温度变化值(约15℃)相近,推测其原因: 。
17.(共6分)
已知2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10( ),
 在高锰酸钾酸性溶液和草酸溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。
在高锰酸钾酸性溶液和草酸溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。
(1) 请写出括号内物质的化学式:
(2) 针对上述实验现象,某同学认为KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你的猜想还可能是 的影响。
(3) 若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液试剂外,还需要选择的试剂最合理的是
A.硫酸钾 B.硫酸锰 C.水 D.氯化锰
16.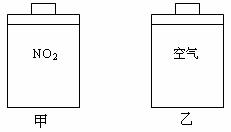 常温常压下,在带有相同质量活塞的容积相等的甲、乙两容器里,分别充有二氧化氮和空气,现分别进行下列两上实验:
常温常压下,在带有相同质量活塞的容积相等的甲、乙两容器里,分别充有二氧化氮和空气,现分别进行下列两上实验:
(N2O4 2NO2 △H
> 0)
2NO2 △H
> 0)
(a)将两容器置于沸水中加热
(b)在活塞上都加2 kg的砝码
在以上两情况下,甲和乙容器的体积大小的比较,
正确的是
A.(a)甲>乙 B.(b)甲>乙 C.(a)甲<乙 D.(b)甲<乙
第Ⅱ部分(非选择题 共60分)
15.在一密闭烧瓶中注入NO2,在25℃时建立下列平衡:2NO2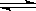 N2O4 △H
< 0,若把烧瓶置于100℃的沸水中,下列情况中不变的是
N2O4 △H
< 0,若把烧瓶置于100℃的沸水中,下列情况中不变的是
A.颜色 B.质量 C.压强 D.密度
14.在密闭容中发生下列反应aA(g) cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
A.A的转化率变小 B.平衡向正反应方向移动
C.D的体积分数变大 D.a < c+d
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com