
题目列表(包括答案和解析)
2、已知某元素的阳离子R2+的核内中子数为n,质量数为A,则mg它的氧化物中所含质子的物质的量是 [ ]
A、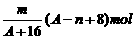 B、
B、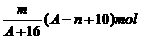
C、(A-n+2)mol
D、 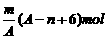
1、合成塑料、合成纤维、合成橡胶所用的最重要的一种天然原料是[ ]
A、煤 B、农副产物 C、石油 D、水和空气
28、(6分)在金属活动性顺序里,位于氢后面的金属Cu,在常温下虽然不能与稀盐酸、稀硫酸反应,但可以与稀硝酸反应,其化学方程式为:
3Cu
+ 8HN03 (稀)===3Cu(NO3)2 + 2NO↑ + 4H20
在3.84 g Cu中加入100 mL稀HNO3溶液,如恰好完全反应,计算生成NO在标准状况下的体积和反应前稀HNO3溶液中溶质的物质的量浓度(请写出计算过程)。

27、(4分)19g某二价金属的氯化物ACl2中含有0.4mol Cl-离子,ACl2的摩尔质量是
g/mol, A的相对原子质量是
。
26、(10分)已知某工业废水中含有大量CuSO4,少量的Ag+、Hg2+以及部分污泥,通过下述过程可从该废水中回收硫酸铜晶体及其它物质。
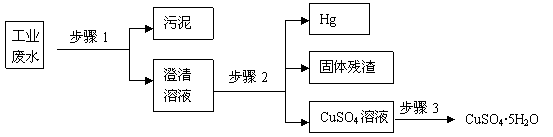



(1)步骤1的主要操作是
,需用到的玻璃仪器除烧杯、玻璃棒外有
。
(2)步骤2中需加入某种试剂后再将混合物分离,该试剂是(填化学式)
,
固体残渣的成分是(填化学式)
。
(3)步骤3中涉及的操作是:蒸发浓缩、
、过滤、烘干。
25、(8分)食盐是日常生活的必需品,也是重要的化工原料。
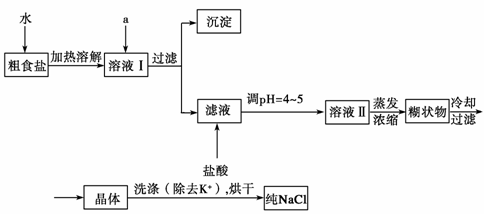 粗食盐常含有少量K+、Ca2+、Mg2+、SO
粗食盐常含有少量K+、Ca2+、Mg2+、SO 等杂质离子,实验室提纯NaCl的流程如下:
等杂质离子,实验室提纯NaCl的流程如下:






提供的试剂: 饱和Na2CO3溶液 饱和K2CO3溶液 NaOH溶液 BaCl2溶液 Ba(NO3)2溶液 75%乙醇 四氯化碳
①欲除去溶液Ⅰ中的Ca2+、Mg2+、SO 离子,选出a所代表的试剂,按滴加顺序依次为
离子,选出a所代表的试剂,按滴加顺序依次为
(只填化学式)。
②洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为
。
(2)用提纯的NaCl配制500 mL 4.00 mol·L-1NaCl溶液,所用仪器除药匙、托盘天平、烧杯、玻璃棒外还有
(填仪器名称)。
24、(10分)用98%的浓硫酸(其密度为1.84g/cm3)配制100mL1.0mol·L-1稀硫酸,若实验仪器有:
A.100mL量筒
B.托盘天平 C.玻璃棒 D.10mL量筒 E.胶头滴管 F.50mL烧杯
G.100mL容量瓶 
(1)需量取浓硫酸的体积为
mL。
(2)实验时不需要的仪器有(填序号)
。
(3)配制过程中,下列情况会使配制结果偏高的是
(填序号)
①定容时俯视刻度线观察液面
②容量瓶使用时未干燥
③定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
(4)在容量瓶使用方法中,下列操作不正确的是(填序号)
。
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配液润洗
C.定容后塞好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转摇匀
23、(8分)现用四氯化碳从碘水中萃取碘并用分液漏斗分离两种溶液。其实验操作可分解为如下几步:
(A)把盛有溶液的分液漏斗放在铁架台的铁圈中;
(B)把50 mL碘水和15 mL四氯化碳加入分液漏斗中,并盖好玻璃塞;
(C)检查分液漏斗活塞和上口的玻璃塞是否漏液;
(D)倒转分液漏斗,用力振荡,并不时旋开活塞放气,最后关闭活塞,分液漏斗放正;
(E)旋开活塞,用烧杯承接溶液;
(F)从分液漏斗上口倒出上层水溶液;
(G)将漏斗上口的玻璃塞打开或使塞上的凹槽或小孔对准漏斗口上的小孔;
(H)静置、分层; 
就此实验,完成下列填空:
⑴正确操作步骤的顺序是:(用上述各操作的编号字母填写) C→ → 
→A→ →G→E→F。
⑵上述(G)步骤的操作目的是
(2分) 
⑶已知碘在酒精中的溶解度比在水中大的多,能不能用酒精来萃取碘水中的碘

(填“能”或“不能”),其理由是
。(2分)
22、(4分)在V L
Al2(SO4)3溶液中,测得含Al3+的质量为a
g,
则Al2(SO4)3溶液的物质的量浓度为 ,SO42-的物质的量浓度为 。
21、(10分)①
1molHNO3的质量是

1mol HNO3约含有__________个氮原子。
②标准状况下11.2LHCl气体的物质的量是
。将此HCl气体 溶于水中配成1L溶液,所得盐酸溶液的物质的量浓度是 。
③2molOH-含有
mol电子。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com