
题目列表(包括答案和解析)
26.(11分)两个学习小组用下图装置探究乙二酸(HOOC-COOH)受热分解的部分产物。
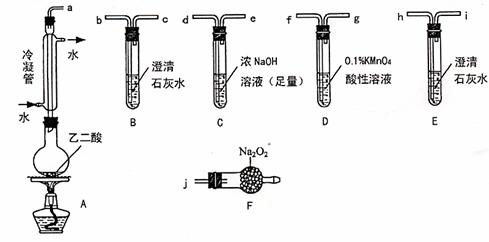
(1)甲组:
①按接口顺序a-b-c-de-f-g-h连接装置进行实验。B中溶液变浑浊,证明分解产物有 ;装置C的作用是 ;E中溶液变浑浊,D中的现象是 ,证明分解产物有
。
②乙二酸受热分解的化学方程式为 。
(2)乙组:
①将接口a与j连接进行实验,观察到F中生成的气体可使带火星的木条复燃,则F中最主要反应的化学方程式为 。
②从A~F中选用装置进行实验,证明甲组通入D装置的气体能否与Na2O2反应。最简单的装置接口连接顺序是 ;实验后用F中的固体进行验证的方法是 (可另选试剂)。
25.(15分)已知A、B、C、D是四种常见单质,其对应元素的原子序数依次增大,其中B、D属于常见金属,J是一种黑色固体,I的浓溶液具有还原性。A~I均为中学化学中常见物质,它们之间的转化关系如下图所示。(部分生物和反应条件已略去)
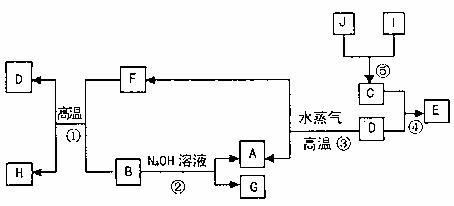
请回答下列问题:
(1)写出组成物质C的元素在元素周期表中的位置: ;
(2)写出反应①的化学方程式: 。
(3)由E的饱和溶液可以制得胶体,具体制备方法是
。用化学方程式表示该过程的原理: 。若要提纯该胶体,采用的操作方法叫 ,提纯后的液体具有的性质是 (填字母序号)。
a.光束通过该液体时形成光亮的“通路”
b.向液体中逐滴加入足量氢碘酸,先有沉淀产生,后沉淀逐渐溶解,再滴入几滴淀粉溶液,溶液变为蓝色
c.向该液体中加入硝酸银溶液,无沉淀产生
d.将该液体加热、蒸干、灼烧,得到红棕色固体
(4)G的水溶液显 性(填“酸”、“碱”或“中”),其原因是(用离子方程式表示) 。
(5)在H2O2分解反应中作催化剂。若将适量J加入酸化的H2O2溶液中,J溶解生成它的+2介离子,则该反应的离子方程式是 。
24.(12分)某100mL溶液中仅含下表离子中的5种离子(不考虑水的电离及离子的水解),
且各离子的物质的量均为0.1mol。
|
阴离子 |
SO2-4、NO-3、Cl- |
|
阳离子 |
Fe3+、Fe2+、NH+4、Cu2+、Al3+ |
①若向原溶液中加入KSCN溶液,无明显变化
②若向原溶液中加入过量的盐酸,有气体生成,溶液中阴离子种类不变
③若向原溶液中加入BaCl2溶液,有白色沉淀生成
试回答下列问题:
(1)原溶液中所含阳离子是(填离子符号,下同) ,阴离子是 。
(2)若向原溶液中先加入少量盐酸,再滴入KSCN溶液,实验中发生的所有反应的离子方程式是 。
(3)若向原溶液中加入足量NaOH溶液,充分反应后静置一段时间,过滤后将沉淀洗涤、灼烧,最终所得固体的质量是 。
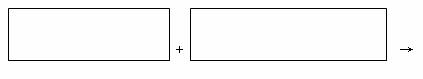
23.(8分)某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。
(1)已知KBrO3在反应中得到电子,则该反应的还原剂是 。
(2)已知0.2molKBrO3在反应中得到1mol电子生成X,则X的化学式为 。
(3)根据上述反应可推知 (填字母序号)。
a.氧化性:KbrO3>H3AsO4` b.氧化性:H3AsO4>KbrO3
c.还原性:AsH3>X d.还原性:X>AsH3
(4)将氧化剂和还原剂的化学式及配平后的系数填入下列方框中,并标出电子转移的方向和数目:
22.某溶液中存在XO-3,且X为短周期元素,则一定能在该溶液中大量共存的离子组是( )
A.Na+、H+、SO2-4、I- B.Na+、Ca2+、CO2-3、Al3+
C.Na+、K+、Fe2+、H+ D.K+、SO2-4、Cl-、CO2-3
第Ⅱ卷(非选择题 共80分)
21.常温下,往H2O2溶液中滴加少量FeSO4溶液,可发生如下两个反应:2Fe2++H2O2+2H+===
2Fe3++2H2O;2Fe3++H2O2===2Fe3++O2↑+2H+。下列说法正确的是 ( )
A.H2O2的氧化性比Fe3+强,其还原性比Fe2+弱
B.在H2O2分解过程中,溶液的pH逐渐下降
C.在H2O2分解过程中,Fe2+和Fe3+的总量保持不变
D.生产H2O2过程中需要加入Fe2+
20.高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,是比Cl2、O3、ClO2KMnO4氧化性更强,无二次污染的绿色水处理剂。工业上是先制得高铁酸钠,然后在低温下,在高铁酸钠溶液中加入KOH至饱和就可析出高铁酸钾(K2FeO4)。
湿法制备的主要反应方程式为:2Fe(OH)3+3ClO-+4HO-=2FeO2-4+3Cl-+5H2O
干法制备的主要反应方程式为:FeSO4+2Na2O2=Na2FeO4+Na2SO4
下列有关说法不正确的是 ( )
A.K2FeO4处理水时,不仅能消毒杀菌,还能吸附水中的悬浮杂质
B.湿法中每生成1molNa2FeO4转移3mol电子
C.干法中每生成1molNa2FeO4转移4mol电子
D.高铁酸钾中铁显+3价
19.25°C,101kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3kJ/mol,辛烷的燃烧热为5518kJ/mol。下列热化学方程式书写正确的是 ( )
A.2H+(aq)+SO2-4(aq)+Ba2+(aq)+2OH-(aq)=BaSO4(s)+2H2O(l);
△H=-57.3kJ/mol
B.KOH(aq)+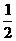 H2SO4(aq)=
H2SO4(aq)=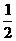 K2SO4(aq)+H2O(l);
K2SO4(aq)+H2O(l);
△H=-57.3kJ/mol
C.C8H18(l)+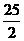 O2(g)=8CO2(g)+9H2O(g);
O2(g)=8CO2(g)+9H2O(g);
△H=-5518kJ/mol
D.2C8H18(g)+25O2(g)=16CO2(g)+18H2O(l);
△H=-11036kJ/mol
18.如图所示的装置,C、D、E、F、X、Y都是惰性电极。将电源接通后,向乙中滴入酚酞溶液,在F极附近显红色。则以下说法不正确的是 ( )
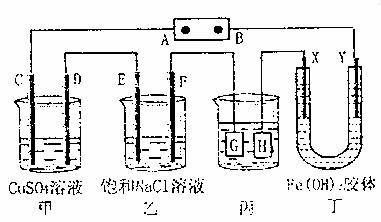
A.电源B极是正极
B.甲、乙装置的C、D、E、F电极均有单质生成,其物质的量之比为1:2:2:2
C.欲用丙装置给铜镀银,G应该是Ag,电镀液选择AgNO3溶液
D.装置丁中C极附近红褐色变浅,说明氢氧化铁胶粒吸附正电荷
17.下列各组物质的溶液,不用其他试剂,也不用焰色反应就能将它们区别开来的是( )
A.AgNO3、NaCl、BaCl2、NaOH
B.K2CO3、KHCO3、HCl、H2SO4
C.Na2CO3、NaHSO4、Ba(NO3)2、KCl
D.KNO3、NaCl、BaCl2、(NH4)2SO4
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com