
题目列表(包括答案和解析)
5.已知X、Y、Z、W四种短周期元素(均非稀有气体元素)在周期表中的相对位置如下图所示,下列说法正确的是 ( )
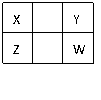 A.Z元素的最高化合价可能比Y元素的高
A.Z元素的最高化合价可能比Y元素的高
B.Z元素的原子半径可能比Y元素的小
C.W的气态氢化物的稳定性一定比Y的强
D.Z的最高价氧化物的水化物的酸性一定比W的强
4.下列有关比较,大小顺序排列错误的是 ( )
①热稳定性:PH3>H2S> HBr>NH3
②碱性:KOH>Ca(OH)2>Mg(OH)2>Al(OH)3
③物质的熔点:石英>食盐>汞>硫
④结合质子(H+)的能力: OH-> CO 32->CH3COO->SO42-
A.①② B.①③ C.②④ D.③④
0.4mol/(L·min)
C.OE、EF、FG三段中,该反应用二氧化碳表示的
平均反应速率之比为2∶6∶7
D.F点表示收集到的CO2的量最多
3.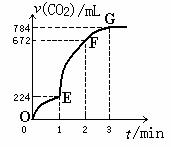 用纯净的CaCO3与100mL稀盐酸反应制取CO2,实验
用纯净的CaCO3与100mL稀盐酸反应制取CO2,实验
过程记录如图所示(CO2的体积已折算为标准状况下
的体积)下列分析正确的是 ( )
A.OE段表示的平均速率最快
B.EF段,用盐酸表示该反应的平均反应速率为
2.下列物质按照纯净物、混合物、电解质和非电解质顺序排列的是 ( )
A.盐酸、天然气、醋酸、干冰 B.胆矾、漂白粉、氯化钾、氯气
C.氯化钠、水垢、硫酸钠、乙醇 D.碘酒、自来水、苛性钾、石灰石
1.下列化学用语错误的是 ( )
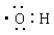
A.羟基电子式
B.Na2S溶液呈碱性S2- + H2O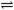 HS-+ OH-
HS-+ OH-

C.氨分子结构示意图 D.乙醇的分子式CH3CH2OH
12、(17分)向一体积不变的密闭容器中加入2mol A、0.6molC和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化如图一所示。图二为t2时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件。已知t3-t4阶段为使用催化剂, t5-t6 阶段为升高温度,图一中t0-t1阶段c(B)未画出。
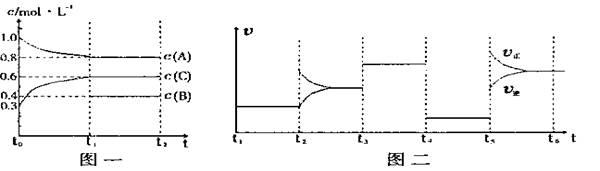
(1)若t1=15min,则t0-t1阶段以C浓度变化表示的反应速率为v(C)= 。
 (2)t4-t5阶段改变的条件为
,B的起始物质的量为
。
(2)t4-t5阶段改变的条件为
,B的起始物质的量为
。
(3)此反应的化学方程式可表示为 ,该反应为
(填“放”或“吸”)热反应。
(4)各阶段平衡时对应的平衡常数如下表所示:
|
t1-t2 |
t2-t3 |
t3-t4 |
t4-t5 |
t5-t6 |
|
K1 |
K2 |
K3 |
K4 |
K5 |
则K1= (保留两位小数),K1、K2、K3、K4、K5之间的关系为 (用“>”、“<”或“=”连接)
11、 (15分)恒温下,将amolN2与bmolH2的混合气体通入一个固定容积的密闭容器中,发生如下反应:N2(g)+3H2(g)
(15分)恒温下,将amolN2与bmolH2的混合气体通入一个固定容积的密闭容器中,发生如下反应:N2(g)+3H2(g) 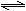 2NH3(g)
2NH3(g)
 (1)若反应进行到某时刻t时,nt(N2)=13mol,nt(NH3)=6mol,则a的值为 。
(1)若反应进行到某时刻t时,nt(N2)=13mol,nt(NH3)=6mol,则a的值为 。
 (2)反应达平衡时,混合气体的体积为716.8L(标准状况下),其中NH3的含量(体积分数)为25%。则平衡时NH3的物质的量为
。
(2)反应达平衡时,混合气体的体积为716.8L(标准状况下),其中NH3的含量(体积分数)为25%。则平衡时NH3的物质的量为
。
 (3)平衡混合气体中,n(N2):n(H2):n(NH3)=
。
(3)平衡混合气体中,n(N2):n(H2):n(NH3)=
。
 (4)原混合气体中,a:b=
。
(4)原混合气体中,a:b=
。
 (5)原混合气体与平衡混合气体的总物质的量之比(写最简整数比,下同),n(始):n(平)= 。 (6)达到平衡时,N2和H2的转化率之比,a(N2):a(H2)=
。
(5)原混合气体与平衡混合气体的总物质的量之比(写最简整数比,下同),n(始):n(平)= 。 (6)达到平衡时,N2和H2的转化率之比,a(N2):a(H2)=
。


10、 (18分)某强酸性反应体系中,反应物和生成物共六种物质:O2 、MnO4-、H2O 、Mn2+ 、H2O2 、H+ 。已知该反应中H2O2 只发生了如下过程:H2O2
→O2。
(18分)某强酸性反应体系中,反应物和生成物共六种物质:O2 、MnO4-、H2O 、Mn2+ 、H2O2 、H+ 。已知该反应中H2O2 只发生了如下过程:H2O2
→O2。
 (1)该反应应选择的酸是:
(填序号)。
(1)该反应应选择的酸是:
(填序号)。

 A.盐酸 B.浓硫酸 C.稀硫酸 D.醋酸。
A.盐酸 B.浓硫酸 C.稀硫酸 D.醋酸。
 (2)该反应中发生还原反应的过程是:
→ 。
(2)该反应中发生还原反应的过程是:
→ 。
 (3)写出该反应配平的离子方程式并标出电子转移的方向和数目:
(3)写出该反应配平的离子方程式并标出电子转移的方向和数目:


 (4)如果上述反应中有6.72L(标准状况.)气体生成,转移的电子数为 mol。
(4)如果上述反应中有6.72L(标准状况.)气体生成,转移的电子数为 mol。
 (5)H2O2有时可作为矿业废液消毒剂,如消除采矿业胶液中的氰化物(如KCN),经以下反应实现:KCN + H2O2+H2O
==== A + NH3↑,试指出生成物A的化学式为 。
(5)H2O2有时可作为矿业废液消毒剂,如消除采矿业胶液中的氰化物(如KCN),经以下反应实现:KCN + H2O2+H2O
==== A + NH3↑,试指出生成物A的化学式为 。
 (6) H2O2还有“绿色氧化剂”的美称,阐明H2O2被称为绿色氧化剂的理由是 。
(6) H2O2还有“绿色氧化剂”的美称,阐明H2O2被称为绿色氧化剂的理由是 。



9、(14分)设反应①Fe(s)+CO2(g) ) FeO(s)+CO(g);△H=Q1的平衡常数为K1,反应②Fe(s)+H2O(g)
FeO(s)+CO(g);△H=Q1的平衡常数为K1,反应②Fe(s)+H2O(g)  FeO(s)+H2(g);△H=Q2的平衡常数为K2,在不同温度下,K1、K2的值如下:
FeO(s)+H2(g);△H=Q2的平衡常数为K2,在不同温度下,K1、K2的值如下:
|
T/K |
K1 |
K2 |
|
973 |
1.47 |
2.38 |
|
1 173 |
2.15 |
1.67 |
(1)从上表可推断,反应①是 (填“放”或“吸”)热反应。
 (2)现有反应③H2(g)+CO2(g)
(2)现有反应③H2(g)+CO2(g) CO(g)+H2O(g);△H=Q3平衡常数为K3。
CO(g)+H2O(g);△H=Q3平衡常数为K3。
根据反应①与②推导出K1、K2、K3的关系式K3= ;
可推断反应③是 (填“放”或“吸”)热反应。要使反应③在一定条件下建立的平衡右
移,可采取的措施有 。
A.缩小容器体积 B.降低温度 C.使用合适的催化剂
D.设法减少CO的量 E.升高温度
(3)根据反应①与②推导出Q1、Q2、Q3的关系式Q3= 。


湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com