
题目列表(包括答案和解析)
2. 下列反应中生成物的总能量高于反应物总能量的是
A.碳酸钙受热分解 B.一氧化碳燃烧
C.铝与氧化铁粉末反应 D.氧化钙溶于水
1. 用铁片与稀硫酸反应制氢气时,下列措施不能使氢气生成速率加大的是
A.加热 B.加水
C.加少量硫酸铜溶液 D.不用铁片,改用铁粉
23.常温下,Ba(OH)2和NaOH混合溶液的pH=14,取该溶液100mL,持续通入CO2,当通入的CO2体积为0.56L时生成沉淀最多,试通过计算回答(气体体积均在标准状况下测得,设溶液体积在反应过程中不发生变化):
(1)混合溶液中NaOH的物质的量浓度各是多少?
(2)当通入的CO2总体积为2.24L时,溶液中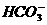 、
、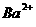 的物质的量浓度各是多少?
的物质的量浓度各是多少?
22.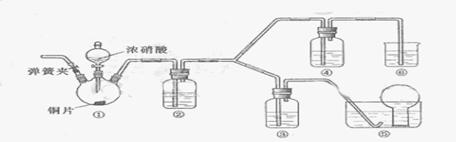 (11分)某学习小组探究浓、稀硝酸氧化性的相对强弱的。按下图装置进行试验。
(11分)某学习小组探究浓、稀硝酸氧化性的相对强弱的。按下图装置进行试验。
实验表明浓硝酸能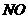 氧化成
氧化成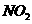 ,而稀硝酸不能氧化
,而稀硝酸不能氧化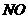 。由此得出的结论是浓硝酸的氧化性强于稀硝酸。
。由此得出的结论是浓硝酸的氧化性强于稀硝酸。
可选药品:浓硝酸、3mo/L稀硝酸、蒸馏水、浓硫酸、氢氧化钠溶液及二氧化碳。
已知氢氧化钠溶液不与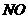 反应,
反应,
能与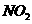 反应
反应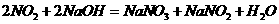
(1)实验应避免有害气体排放到空气中,装置③、④、⑥中盛放的药品依次是________、________、________。
(2)滴加浓硝酸之前的操作是检验装置的气密性,加入药品,打开弹簧夹以及_________
_____________________________________________。
(3)装置①中发生反应的化学方程式是_______________________________。
(4)装置②的作用是 ,发生反应的化学方程式是________________。
(5)该小组得出结论依据的试验现象是_______________________________。
(6)试验结束后,同学们发现装置①中溶液呈绿色,而不显蓝色。甲同学认为是该溶液中硝酸铜的质量分数较高所致,而乙同学认为是该溶液中溶解了生成的气体。同学们分别涉及了一下4个试验来判断两种看法是否正确。这些方案中可行的是(选填序号字母)___________________
a.加热该绿色溶液,观察颜色变化
b.加水稀释绿色溶液,观察颜色变化
c.向该绿色溶液中通入氮气,观察颜色变化
d.向饱和硝酸铜溶液中通入浓硝酸与铜反映产生的气体,观察颜色变化
21.(8分)下表是元素周期表中短周期部分,表中所列字母分别代表一种元素。
|
A |
|
|
|
|
|
|
|
|
|
|
|
B |
C |
D |
E |
|
|
F |
|
|
|
|
|
G |
H |
(1)上述元素的单质中熔点最高的元素名称是 ,
F、G、H中原子半径最小的元素符号是 ,
E、F、G离子半径由小到大的顺序是 ,
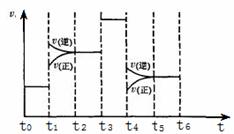 F的离子结构示意图__________(本小题用化学
F的离子结构示意图__________(本小题用化学
用语及名称回答)。
(2)A、B、D、F四种元素组成的受热易分解的化合
物,写出少量该化合物溶液与足量Ba(OH)2溶
液反应的离子方程式 。
(3)常温下,ACD3和盐A4C2D3的水溶液pH均为6。
则两种水溶液中由水电离出的H+ 浓度之比是 。
(4)化学反应3A2(g)+C2(g)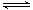 2CA3(g)。当反应达到
2CA3(g)。当反应达到
平衡时不断改变条件(不改变A2、C2和CA3的量),图中表示反应速率与反应过程的关系,其中表示 平衡混合物中CA3含量最高的一段时间是 __ 。温度为T℃时,将4mol A2和2mol C2放入1L密 闭容器中,60s后测得C2的转化率为50%,则A2的反应速率为 。
20.(9分) 在一定条件下,二氧化硫和氧气发生如下反应:
 2SO2(g)+O2(g)
2SO2(g)+O2(g) 2SO3(g);△H < 0
2SO3(g);△H < 0
(1)一定体积的密闭容器中判断该反应达到平衡状态的标志
是 。(填字母)
a.SO2和SO3浓度相等
b.容器中混合气体的密度保持不变
c.容器中气体的压强不变 d.SO2百分含量保持不变
e.SO3的生成速率与SO2的消耗速率相等
(2)降低温度,二氧化硫转化率 ,化学反应速
率 (以上均填“增大”、 “减小”或 “不
变”)
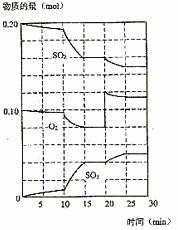
(3)600℃时,在一密闭容器中,将二氧化硫和氧气混合,反
应过程中SO2、O2、SO3物质的量变化如图,反应处于平
衡状态的时间是 。
(4)据图判断,反应进行至20 min时,曲线发生变化的原因是 (用文字表达),10 min 到15 min的曲线变化的原因可能是 (填写编号)。
a.加了催化剂 b.缩小容积体积
c.降低温度 d.增加SO3的物质的量
19.(7分)如图所示其中A、G是固体单质,其余是化合物。X是常用于切割和焊接金属的可燃性气体,Y是一种难溶于水的白色固体,它的式量是100。请填空:
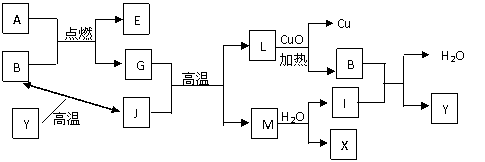
(1)B的结构式为 ,M的电子式为 。
(2)A跟B反应的化学方程式是 。该反应的反应热△H_____0(填“<、=、>”)。
(3)在高温条件下,G跟J反应的化学方程式是 。
(4)上图中,置换反应共有_______个。
(5)1g X完全燃烧生成B和H2O(l)放热Q kJ的热量试写出该反应的热化学方程式:
______________________________________________________________。
18.(8分)现有A、B、C、D、E、F六种化合物,
已知它们的阳离子有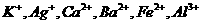 ,
,
阴离子有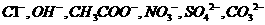 ,现将它们分别配成
,现将它们分别配成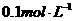 的溶液,进行如下实验:
的溶液,进行如下实验:
(1)测得溶液A、C、E呈碱性,且碱性为A>E>C;
向B溶液中滴加稀氨水,先出现沉淀,继续滴加氨水,沉淀消失;
向D溶液中滴加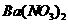 溶液,无明显现象;
溶液,无明显现象;
向F溶液中滴加氨水,生成白色絮状沉淀,沉淀迅速变成灰绿色,最后变成红褐色。
根据上述实验现象,回答下列问题:
实验②中反应的化学方程式是:_________________________________________;
____________________________________________。
(2)E溶液是 ,判断依据是:__________________________________________;
____________________________________________。
(3)写出下列四种化合物的化学式:A 、C 、D 、.
(4)采用石墨为电极电解A溶液其阳极电极反应为:___________________________。
17.(4分) 铜和硝酸反应的物质的量的关系如图所示,纵坐标表示消耗铜的物质的量,横坐标表示消耗硝酸的物质的量,坐标图中各条线表示下列A、B、C、D中哪个反应:(填写序号,下同)
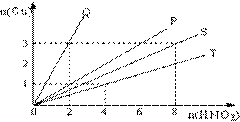 A、铜和浓硝酸
A、铜和浓硝酸
B、铜和稀硝酸
C、铜和被还原的浓硝酸
D、铜和被还原的稀硝酸
(1)Q表示反应 ; (2)P表示反应 ;
(3)S表示反应 ; (4)T表示反应 。
16.已知0.1 mol·L-1的二元酸H2A溶液的pH=4.0,则下列说法正确的是 ( )
A.在Na2A、NaHA两溶液中,离子种类不相同
B.在溶质物质的量相等的Na2A、NaHA两溶液中,阴离子总数相等
C.在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+2c(A2-)
D.在Na2A溶液中一定有:c(Na+)>c(A2-)>c(H+)>c(OH-)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com